
| A. | $\frac{m(A-N)}{A}$ mol | B. | $\frac{m(A-N-2)}{A}$ mol | C. | $\frac{(A-N+2)}{Am}$ mol | D. | $\frac{m(A-N+2)}{A}$ mol |
分析 质量数=质子数+中子数计算质子数,阳离子中核外电子数=质子数-核电荷数,据此计算R2+中电子数,相对原子质量在数值上等于其质量数;然后根据n=$\frac{m}{M}$×一个离子中的电子数计算电子的物质的量.
解答 解:R2+核内共有N个中子,R的质量数为A,质量数═质子数+中子数计算质子数,所以其质子数=A-N,阳离子中核外电子数=质子数-核电荷数=A-N-2,即一个该离子中含有(A-N-2)个电子;
相对原子质量在数值上等于其质量数等于其摩尔质量,所以其摩尔质量为Ag/mol,m gR2+中含电子的物质的量=$\frac{m}{M}$=$\frac{mg}{Ag/mol}$=$\frac{m(A-N-2)}{A}$mol;
故选:B.
点评 本题考查了质子数、中子数、核外电子数及其相互关系,难度不大,明确各物理量间的关系是解本题的关键,注意电子的质量可忽略,质量数近似等于相对原子质量.


科目:高中化学 来源: 题型:选择题
| A. | 2:1:2 | B. | 2:1:3 | C. | 6:3:2 | D. | 3:7:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有离子键的化合物中一定没有共价键 | |
| B. | 有共价键的化合物中一定没有离子键 | |
| C. | 物质的熔化过程可能既破坏离子键又破坏共价键 | |
| D. | 物质的熔化过程可能不破坏任何化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
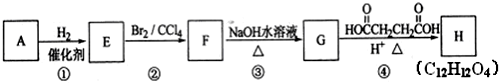
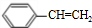 +Br2→
+Br2→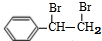
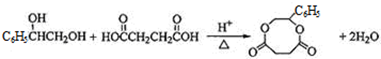
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
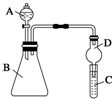 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | X | R | T |
| 原子半径(nm) | 0.110 | 0.113 | 0.102 | 0.075 | 0.071 |
| 主要化合价 | +5-3 | +3 | +6-2 | +5-3 | -2 |
| A. | 离子半径大小:r(M3+)>r(T2-) | B. | 氢化物稳定性:L<R | ||
| C. | X与T只能形成一种化合物 | D. | 含有M的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |
| Z | W |
| A. | 原子半径:Z>X>Y | |
| B. | Y的最高正价与最低负价的和是4 | |
| C. | W的单质是工业制取盐酸的原料之一 | |
| D. | X、W的氢化物相遇会产生白烟 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com