
| A. | 50 kJ/mol | B. | 3900 kJ/mol | C. | 1300 kJ/mol | D. | 450 kJ/mol |
分析 已知燃烧1g乙炔物质的量n=$\frac{m}{M}$=$\frac{1g}{26g/mol}$=$\frac{1}{26}$mol,反应生成二氧化碳气体和液态水时,放出50kJ热量,而燃烧热是在101kp时1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,据此分析.
解答 解:燃烧热是在101kp时1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,而燃烧1g乙炔物质的量n=$\frac{m}{M}$=$\frac{1g}{26g/mol}$=$\frac{1}{26}$mol,反应生成二氧化碳气体和液态水时,放出50kJ热量,故燃烧1mol乙炔生成二氧化碳气体和液态水时,放出热量为50kJ×26=1300KJ,故选C.
点评 本题考查反应热的计算,明确物质的量与热量的关系式解答的关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
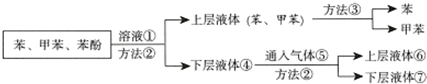
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原氨水的浓度为10-3 mol•L-1 | |
| B. | 溶液中$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| C. | 氨水的电离程度增大,溶液中所有离子的浓度均减小 | |
| D. | 再加入10 mL pH=3的盐酸充分反应后混合液的pH值肯定等于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
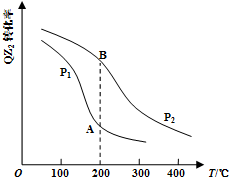 X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答:
X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答: .
.| 气体 | QZ2 | Z2 | QZ3 |
| 浓度(mol/L) | 0.4 | 1.2 | 1.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水中溶解性:Na2CO3>NaHCO3 | |
| B. | 热稳定性:Na2CO3<NaHCO3 | |
| C. | 与相同浓度的盐酸反应的速度:Na2CO3>NaHCO3 | |
| D. | Na2CO3与NaHCO3相互转化的反应是可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中只能含离子键,不能有共价键 | |
| B. | 所有非金属之间形成的化学键一定是共价键 | |
| C. | 电子数相同的两种微粒一定是同一元素 | |
| D. | 化学变化一定有化学键的断裂和形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和② | B. | ②和③ | C. | 只有④ | D. | 只有③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com