
分析 (1)在1L水中可溶解0.09mol氯气,近似氯气难度为0.09mol/L;结合平衡计算平衡状态微粒的浓度,依据平衡常数概念计算得到;
(2)氯气与水反应生成盐酸和次氯酸,次氯酸是弱电解质,化学平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$,注意固体和纯液体不写入表达式;
(3)气体溶解度随压强增大会增大,平衡向气体体积减小的方向进行;
(4)依据电离平衡常数判断出的酸性H2CO3 >HClO>HCO3-;依据酸性强弱分析反应产物.
解答 解:(1)在1L水中可溶解0.09mol氯气,近似氯气浓度为0.09mol/L,溶于水的Cl2约有三分之一与水反应反应的氯气为0.03mol,
Cl2+H2O?H++Cl-+HClO
起始浓度:0.09 0 0 0
转化浓度:0.03 0.03 0.03 0.03
平衡浓度:0.06 0.03 0.03 0.03
K=$\frac{c({H}^{+})c(C{l}^{-})c(HClO)}{c(C{l}_{2})}$=$\frac{0.0{3}^{3}}{0.06}$=4.5×10-4,
故答案为:4.5×10-4;
(2)氯气与水反应生成盐酸和次氯酸,反应的离子方程式为:Cl2+H2O?H++Cl-+HClO,平衡常数表达式K=$\frac{c({H}^{+})c(C{l}^{-})c(HClO)}{c(C{l}_{2})}$,
故答案为:Cl2+H2O?H++Cl-+HClO,$\frac{c({H}^{+})c(C{l}^{-})c(HClO)}{c(C{l}_{2})}$;
(3)在上述平衡中加压,平衡向气体体积减小的反应方向进行,平衡都向正反应方向移动,氯气的溶解量会增加,
故答案为:增大;向右移动;
(4)将少量的氯气通入到过量的碳酸钠溶液中,氯气和水反应生成的盐酸反应生成碳酸氢钠,次氯酸酸性强于碳酸氢根离子,反应生成碳酸氢钠,反应的离子方程式为:Cl2+2CO32-+H2O═2HCO3-+Cl-+ClO-,
故答案为:Cl2+2CO32-+H2O═2HCO3-+Cl-+ClO-.
点评 本题考查了氯气性质、化学平衡的影响因素影响、平衡计算应用、Cl2溶于水的离子反应方程式,其中平衡常数的大小比较、压强对平衡移动的影响判断是解题关键,题目难度中等.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:选择题
| A. | 保证装置不漏气 | |
| B. | 镁带称量后,用砂皮擦去表面的氧化层 | |
| C. | 用针筒注入硫酸后,拔出速度要快 | |
| D. | 镁带的质量要使产生的氢气足以计量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
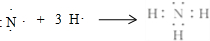 .
.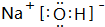 ,在该化合物中既含有离子键,又含有共价键.
,在该化合物中既含有离子键,又含有共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
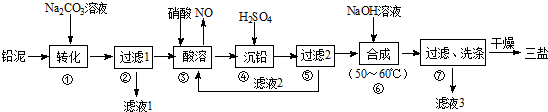
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶于水:NaHCO3═Na++H++CO32- | |
| B. | H2CO3?2H++CO32- | |
| C. | Al(OH)3酸式电离:Al(OH)3═H2O+AlO2-+H+ | |
| D. | NaHSO4熔化:NaHSO4═Na++HSO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
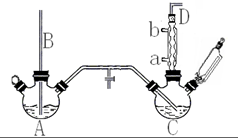 氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取.反应原理、实验装置图(加热装置都已略去)如下:
氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取.反应原理、实验装置图(加热装置都已略去)如下:
| 项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
| 苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | NaClO | C. | NaCl | D. | Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 mol/L | B. | 2.0 mol/L | C. | 3.0 mol/L | D. | 4.0 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由H原子形成1 mol H-H键要吸收能量 | |
| B. | 所有燃烧的反应都是放热反应 | |
| C. | NaOH溶于水是放热反应 | |
| D. | 凡经加热而发生的化学反应都是吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com