
����Ŀ������β���ѳ�Ϊ���п�������Ҫ��ȾԴ֮һ�����еĵ�����������Ҫ��Ⱦ�
��1��������ȼ������ʱ����NO��ԭ����ͼ1��ʾ��

�÷�Ӧ���Ȼ�ѧ����ʽΪ______��
��2������β���ķ���֮һ�����������ϰ�װ��ת�������������·�Ӧ��2NO(g)��2CO(g)![]() N2(g)��2CO2(g) ��H��0������һ���¶��½�2mol NO��1mol CO����1L�̶��ݻ��������У���Ӧ�����и����ʵ�Ũ�ȱ仯��ͼ2��ʾ��
N2(g)��2CO2(g) ��H��0������һ���¶��½�2mol NO��1mol CO����1L�̶��ݻ��������У���Ӧ�����и����ʵ�Ũ�ȱ仯��ͼ2��ʾ��
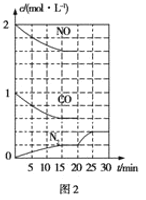
����ӿ�ʼ���ﵽƽ��״̬�Ĺ����У�ƽ����Ӧ������(CO2)=____�����¶��·�Ӧ��ƽ�ⳣ��K=____(���������λ��Ч����)
��20minʱ�ı������������____
A.����ѹǿ C.��СCO2Ũ���Ҹ��ø���Ч�Ĵ���
B.�����¶� D.�ں��º��������£�����He����
���������¶Ȳ��䣬20minʱ�������г���CO��N2��0.6mol��ƽ�⽫____(��������������������������)�ƶ���
��3���ý�̿��ԭNO2�ķ�ӦΪ��2NO2(g)��2C(s)![]() N2(g)��2CO2(g)���ں��������£���1L�ܱ������м��벻ͬ���ʵ�����NO2������C�����÷�Ӧ�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹǿ�Ĺ�ϵ��ͼ3��ʾ��
N2(g)��2CO2(g)���ں��������£���1L�ܱ������м��벻ͬ���ʵ�����NO2������C�����÷�Ӧ�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹǿ�Ĺ�ϵ��ͼ3��ʾ��
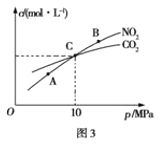
����������˵���÷�Ӧ�Ѵﵽƽ��״̬����_____
a.C���������� b. ���������ܶȲ��ٷ����ı�
c. v��(N2)������(CO2) d.����������ɫ���ٸı�
�ڼ���C��ʱ�÷�Ӧ��ƽ�ⳣ��Kp(C)=___(Kp����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)��
���𰸡�N2(g)��O2(g)=2NO(g) ��H=+180kJ��mol-1 0.027mol��L-1��min-1 0.035 C �� c 2
��������
(1)�����ʱ���H=��Ӧ��ļ���֮��-������ļ���֮�ͣ����ͼʾ�������
(2)�ٸ���ͼʾ�е�����Ũ�ȱ仯����ƽ��ʱ������̼��Ũ�ȣ�������ֵ�ƽ��Ũ�ȴ���ƽ�ⳣ������ʽK= ���㣻��2NO(g)��2CO(g)
���㣻��2NO(g)��2CO(g)![]() N2(g)��2CO2(g)������ͼ��20minʱ������Ũ��������ƽ�����0.4 mol/L���ҽ���ƽ����Ҫ��ʱ����٣����Ӱ��ƽ���Ԫ�ط����жϣ��۸���Ũ����Qc��K�Ĵ�С�����жϣ�
N2(g)��2CO2(g)������ͼ��20minʱ������Ũ��������ƽ�����0.4 mol/L���ҽ���ƽ����Ҫ��ʱ����٣����Ӱ��ƽ���Ԫ�ط����жϣ��۸���Ũ����Qc��K�Ĵ�С�����жϣ�
(3)�ٸ���ƽ��״̬�������ͱ�־�����жϣ��ڸ�������ʽ���C��ʱNO2��CO2�����ʵ���Ũ����ȼ�����
(1)����ͼʾ��������ȼ������ʱ����NO��ԭ��ΪN2(g)��O2(g)=2NO(g)���ʱ���H=��Ӧ��ļ���֮��-������ļ���֮��=[946 kJ/mol +498 kJ/mol]-632 kJ/mol��2= +180kJ/mol���ʴ�Ϊ��N2(g)��O2(g)=2NO(g) ��H=+180kJ/mol��
(2)��ƽ��ʱ������Ũ��Ϊ0.2mol/L���������̼��ƽ��Ũ��Ϊ0.2mol/L��2=0.4mol/L��ƽ����Ӧ������(CO2)=![]() = 0.027mol��L-1��min-1���ɷ���ʽ2NO(g)��2CO(g)
= 0.027mol��L-1��min-1���ɷ���ʽ2NO(g)��2CO(g)![]() N2(g)��2CO2(g) ��H��0��֪��ƽ�ⳣ��K=
N2(g)��2CO2(g) ��H��0��֪��ƽ�ⳣ��K= =
=![]() =
=![]() (L/mol)= 0.035���ʴ�Ϊ��0.027mol��L-1��min-1��0.035��
(L/mol)= 0.035���ʴ�Ϊ��0.027mol��L-1��min-1��0.035��
��2NO(g)��2CO(g)![]() N2(g)��2CO2(g)������ͼ��20minʱ������Ũ��������ƽ�����0.4 mol/L���ҽ���ƽ����Ҫ��ʱ����١�A.����ѹǿ����С�����������������Ũ�Ȼ�ͻȻ������ͼ������A����B. ����ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ��������Ӧ�����ƶ���������Ũ����������Ӧ���ʼ���������ƽ����Ҫ��ʱ���������B����C.��СCO2Ũ�ȣ�ƽ�������ƶ���������Ũ���������������ƽ�ⲻһ�������ܹ����̽���ƽ����Ҫ��ʱ�䣬��C��ȷ��D.�ں��º��������£�����He���壬ƽ�ⲻһ����������Ũ�Ȳ��䣬��D���ʴ�Ϊ��C��
N2(g)��2CO2(g)������ͼ��20minʱ������Ũ��������ƽ�����0.4 mol/L���ҽ���ƽ����Ҫ��ʱ����١�A.����ѹǿ����С�����������������Ũ�Ȼ�ͻȻ������ͼ������A����B. ����ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ��������Ӧ�����ƶ���������Ũ����������Ӧ���ʼ���������ƽ����Ҫ��ʱ���������B����C.��СCO2Ũ�ȣ�ƽ�������ƶ���������Ũ���������������ƽ�ⲻһ�������ܹ����̽���ƽ����Ҫ��ʱ�䣬��C��ȷ��D.�ں��º��������£�����He���壬ƽ�ⲻһ����������Ũ�Ȳ��䣬��D���ʴ�Ϊ��C��
���������¶Ȳ��䣬20minʱ���������г���CO��N2��0.6mol����Ũ����Qc=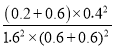 =
=![]() =K����ƽ�ⲻ�ƶ����ʴ�Ϊ������
=K����ƽ�ⲻ�ƶ����ʴ�Ϊ������
(3)��a.C���������䣬���������غ㶨�ɣ�˵���������ʵ�����Ҳ���䣬˵���ﵽ��ƽ��״̬����a��ѡ��b.���������ܶ������������������йأ����������ܶȲ��ٷ����ı䣬˵�����������������䣬˵���ﵽ��ƽ��״̬����b��ѡ��c.v��(N2)��2����(CO2)˵�����淴Ӧ������ȣ�v��(N2)������(CO2)��û�дﵽƽ��״̬����cѡ��d.����������ɫ���ٸı䣬˵������������Ũ�Ȳ��䣬˵���ﵽ��ƽ��״̬����d��ѡ���ʴ�Ϊ��c��
��1molNO2������C�����÷�Ӧ���跴Ӧ�Ķ������������ʵ���Ϊx��
2NO2(g)+2C(s)N2(g)+2CO2(g)
��ʼ(mol)�� 1 0 0
ת��(mol)�� x
ƽ��(mol)�� 1-x 0.5x x
��ͼ֪C��ʱNO2��CO2�����ʵ���Ũ����ȣ���1-x=x�����x=0.5����ƽ��ʱ�ܵ����ʵ���Ϊ1.25mol��C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp(C)= =2MPa���ʴ�Ϊ��2MPa(��2)��
=2MPa���ʴ�Ϊ��2MPa(��2)��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ơ���������������Ҫ�Ľ�������ش�
(1)��ǰ��������ߣ���;���Ľ�����_____________��
(2)�����ֽ����Ľ��������ǿ������˳����_______________ ��
(3)�������о�ˮ�����á�д�������������뷽��ʽ��_____________ ��
(4)С�������Ͷ��ˮ�У�������Ӧ�Ļ�ѧ����ʽΪ_____________���ɹ۲쵽��ʵ��������_____(����ĸ)��
a.�Ƴ���ˮ�� b.���۳�С�� c.С���Ĵ��ζ�d.ˮ���ɫ
(5)��������������������Һ��Ӧ��õ���״���µ�����2.24L����μӷ�Ӧ����������Ϊ_____ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ǽ�����̼���衢�ȡ����ȣ����仯����ǹ�����Ȼ�����Ҫ���ʣ���������������������й㷺��Ӧ�á�
��1��a��̼���ơ�b��������c���������ơ�d���������衢e������5�������У�
�������ε���___������ţ���
��ˮ������Ҫ�ɷ���___��
��ˮ��Һ����Ư���Ե���___��
��2��̼��������ˮ�������룬����뷽��ʽΪ___��
��3�������Ƶ�ˮ��Һ�׳�ˮ��������ˮ�����еμ�������������һ��������д���������Ļ�ѧʽ____��
��4��ij��������������й©�¼���������Ա����NaOH��Һ�γ�ҺĻ����Χ������й©���������䷴Ӧԭ��Ϊ___(�û�ѧ����ʽ��ʾ)��
��5����H2S ������Һ��ͨ�����������ϳ����˵���ɫ���ǣ���Һ����������ǿ����д���÷�Ӧ�Ļ�ѧ����ʽ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾA��F����������

��1��C��___��������������գ���ͬ����D��___�����þƾ��Ƽ��ȵ���___��
��2������ʵ��������õ�����E����___��ѡ������ѡ��ı����ĸ����
a������ˮ��CC14�Ļ���� b������ˮ�;ƾ��Ļ���� c������ˮ����ɰ�Ļ����
��3��ʵ��������һ�����ʵ���Ũ�ȵ����ᣬ�����ܶ�Ϊ1.25g mL-1�� 37%��Ũ����4.5mL��
��ȡ��4.5mL����ʱ����Ҫ�õ����������е�F��___��ѡ�������ı����ĸ����
��ȡ��4.5mL���ᣬ����D��250mL������������һ�����ʵ���Ũ�ȵ����ᣬ��ȷ������õ��������ʵ���Ũ��Ϊ___mol/L������2λ��Ч���֣���
����������У���ʹ������ҺŨ��ƫ�ߵ���___������ţ���
A����ȡ��������۲�Һ��ʱ���� B������ƿ������������ˮ
C��������ˮʱ�����������˿̶��� D������ʱ���ӿ̶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
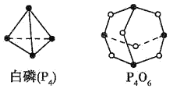
����Ŀ����1����ѧ��Ӧ����Ϊ�ɼ����Ѻ��¼��γɵĹ��̣���ѧ���ļ������γ�(���)1mol��ѧ��ʱ�ͷ�(������)����������֪����P4O6�ķ��ӽṹ��ͼ��ʾ�����ṩ���»�ѧ���ļ��ܣ�P-P��198kJ��mol-1��P-O��360 kJ��mol-1��O=O��498kJ��mol-1����ӦP4(����)��O2��Ӧ����P4O6���Ȼ�ѧ��Ӧ����ʽΪ____��
��2����(N2H4)����Ϊ�����������ȼ�ϣ���������N2O4��Ӧ����N2��ˮ��������֪��
��N2(g)��2O2(g)�TN2O4(l) ��H1�T-19.5kJ/mol
��N2H4(l)��O2(g)�TN2(g)��2H2O(g) ��H2�T-534.2kJ/mol
д���º�N2O4��Ӧ���Ȼ�ѧ����ʽ_____��
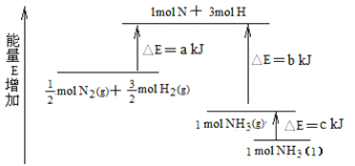
��3����ѧ��ӦN2��3H2![]() 2NH3�������仯��ͼ��ʾ���÷�Ӧ����NH3(l)���Ȼ�ѧ����ʽ��_____��
2NH3�������仯��ͼ��ʾ���÷�Ӧ����NH3(l)���Ȼ�ѧ����ʽ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ�Һϳɵĸ��Ļ����ͨ���������[ph3C]+[B(C6F5)4]-�����ϩ�ۺϱ���ϺõĴ����ԡ��ϳ����Ļ����������һ����Ӧ���£��÷�Ӧ�漰H��C��N��O��Cl��Cr�ȶ���Ԫ�ء�
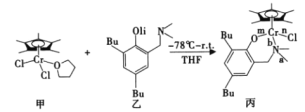
�ش��������⣺
(1)����״̬�����У����������һ��������������������_____________(����)��
A��![]() B��
B��![]()
C��![]() D��
D��![]()
(2)����������̼ԭ�Ӳ�ȡ���ӻ���ʽΪ______�����������a��b��n��m���Ļ�ѧ������λ������______(����ĸ)����
(3)Cr3+���н�ǿ���ȶ��ԣ�Cr3+�ĺ�������Ų�ʽΪ______����֪û��δ�ɶ�d���ӵĹ��ɽ��������γɵ�ˮ����������ɫ�ģ�Ti4+��V3+��Ni2+�������ӵ�ˮ������Ϊ����ɫ����______(�����ӷ���)��
(4)ClO3-�ļ���С��ClO4-�ļ��ǣ�ԭ����______��
(5)���ݽṹ�����ʵĹ�ϵ���ͣ�HNO2�����Ա�HNO3����ԭ��______��
(6)ˮ�ںϳɸ��Ļ�����Ĺ��������ܼ����о�����ˮ�������13�����͵Ľᾧ�塣�����ر�(�ܶȱ�ˮ��)����������ϵ��������������x��y��z���ͶӰͼ��ͼ��ʾ�������е�H2O��λ��Ϊ_____�����߳�Ϊa pm�����ر����ܶ�Ϊ ____g��cm-3��д����ѧ����ʽ��NAΪ����٤����������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������þ��Mg3N2����һ�ָ�ǿ�ȸ�ұ�������Ӽ�����ijѧϰС����������װ���Ʊ���������þ��
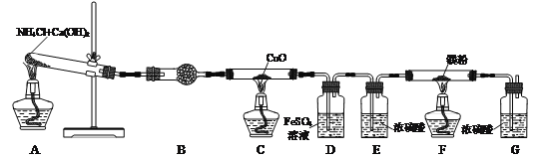
��֪����3Mg��N2![]() Mg3N2����Mg3N2��6H2O=3Mg(OH)2��2NH3��
Mg3N2����Mg3N2��6H2O=3Mg(OH)2��2NH3��
��1������װ�������Եķ�����___��
��2��д��װ��A�з�����Ӧ�Ļ�ѧ����ʽ��___��װ��B���Լ���������___��
��3����Ӧһ��ʱ���װ��C�к�ɫ�����Ϊ��ɫ������ˮ����֡�װ��C�з�����Ӧ�Ļ�ѧ����ʽΪ___��
��4��װ��D��FeSO4��Һ��������___��
��5��ʵ�������װ��A��FӦ���ȼ��ȵ���___����
��6��װ��F���е���þ���ɣ�д��ͨ��ʵ����֤����þ���ɵIJ���������ȡ����װ��F��Ӧ��Ĺ������Թ��У�___��˵�����к�����þ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ������˿��Cl2Ϊԭ�Ͻ�����������ʵ�顣���дӷ���Ƕȷ�����ȷ����

A.ʵ��١��۷�Ӧ�Ƶõ����ʾ�Ϊ������
B.�۷�����ѧ�仯�����յõ��ķ�ɢϵΪ����
C.�ٷ�Ӧ����˿Ϊ��ԭ����������ԭ��Ӧ
D.ʵ��١����漰���������ʾ�Ϊ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ��������������ȷ����( )
A.���³�ѹ�£�32 g���������ԼΪ22.4L
B.1.8 g NH4+�к��е�������ΪNA
C.���³�ѹ�£�48g O3���е���ԭ����Ϊ3NA
D.2.4 g����þ��Ϊþ����ʱʧȥ�ĵ�����Ϊ0.1NA
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com