
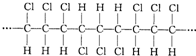
| A. | 合成该聚合物的单体是CHC1=CHC1 | |
| B. | 聚合物的链节(重复的基本结构单元)为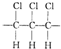 | |
| C. | 聚合物的分子式为C3H3C13 | |
| D. | 该聚合物可表示为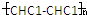 ,其中n为定值 ,其中n为定值 |
分析 从所给结构片断可看出它一直在重复链节 ,因此合成它的单体为CHC1=CHC1,其分子式可表示为
,因此合成它的单体为CHC1=CHC1,其分子式可表示为 CHC1-CHC1
CHC1-CHC1 ,分子式为(C2H2Cl2)n,聚合度n不是定值.
,分子式为(C2H2Cl2)n,聚合度n不是定值.
解答 解:A.该高分子化合物的链节是: ,将两个半键闭合可得其单体:CHCl═CHCl,故A正确;
,将两个半键闭合可得其单体:CHCl═CHCl,故A正确;
B.因为高分子主链上均为C原子,又由于链节是重复的结构单元,且碳碳单键可以旋转,所以该高分子化合物的链节是: ,故B错误;
,故B错误;
C.该聚合物的分子式为:(C2H2Cl2)n,故C错误;
D.该高分子化合物的链节是: ,分子式可表示为
,分子式可表示为 CHC1-CHC1
CHC1-CHC1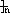 ,其中n不是定酯,故D错误;
,其中n不是定酯,故D错误;
故选A.
点评 本题考查对高分子化合物的生成与结构、加聚反应原理,题目难度不大,找准链节是解题的关键,注意高聚物的结构简式、分子式应体现单体,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 4个 | B. | 6个 | C. | 8个 | D. | 12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl固体 | B. | H2SO4 | C. | NaOH固体 | D. | 大量水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
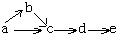 a、b、c、d、e五种物质均含有一种相同的元素,在一定条件下可发生如图所示转化,其中a 是单质;b在通常状况下是气体; c、d都是氧化物;e是该元素的最高价
a、b、c、d、e五种物质均含有一种相同的元素,在一定条件下可发生如图所示转化,其中a 是单质;b在通常状况下是气体; c、d都是氧化物;e是该元素的最高价| A. | N2 | B. | C12 | C. | Si | D. | C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醛和乙酸乙酯 | B. | 甲酸和乙酸 | ||
| C. | 甲醛和乙醇 | D. | 甲酸甲酯和乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
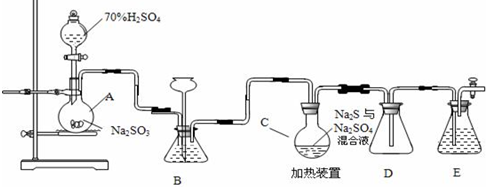
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
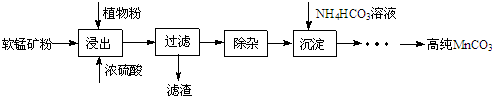
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g) | B. | C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(1) | ||
| C. | C2H2(g)+$\frac{3}{2}$O2(g)=2CO2(g)+H2O(g) | D. | C2H2(g)+$\frac{3}{2}$O2(g)=2CO(g)+H2O(1) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com