
| A. | 18O只存在于乙酸分子中 | |
| B. | 18O存在于乙酸和乙酸乙酯中分子中 | |
| C. | 18O只存在于乙醇分子中 | |
| D. | 18O存在于水、乙酸分子中 |
科目:高中化学 来源: 题型:填空题
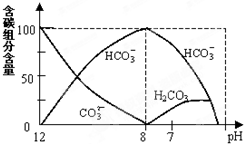 在含有弱电解质的溶液中,往往有多个化学平衡共存
在含有弱电解质的溶液中,往往有多个化学平衡共存查看答案和解析>>
科目:高中化学 来源: 题型:解答题
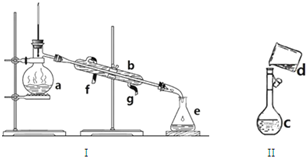
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②④ | C. | ①②③④ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
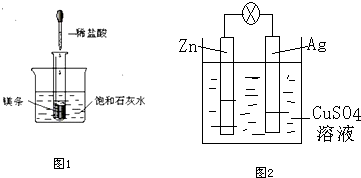
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
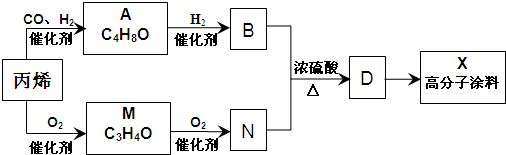
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-→ClO-+Cl-+H2O | |
| B. | 该消毒液的pH约为12:ClO-+H2O?HClO+OH- | |
| C. | 该消毒液与洁厕灵(主要成分为HCl)混用,产生有毒Cl2:2H++Cl-+ClO-→Cl2↑+H2O | |
| D. | 该消毒液加白醋生成HClO,可增强漂白作用:H++ClO-→HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池工作时,化学能转化为电能 | |
| B. | 手机电池在充电时,是电能转变为化学能 | |
| C. | 煤燃烧时,化学能主要转化为热能 | |
| D. | 人体运动所消耗的能量与化学反应无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
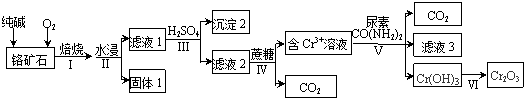
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com