
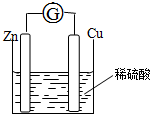
 将锌片和铜片用导线相连浸入稀硫酸中组成原电池,两电极间连接一个电流计,装置如图:
将锌片和铜片用导线相连浸入稀硫酸中组成原电池,两电极间连接一个电流计,装置如图:分析 (1)该原电池中,锌易失电子发生氧化反应而作负极,铜作正极,正极上氢离子得电子发生还原反应;
(2)负极上锌生成锌离子进入溶液而导致质量减少,正极上氢离子得电子生成氢气,所以正极质量不变,两个电极减少的质量是锌的质量,根据锌和氢气之间的关系式计算生成氢气的体积.
解答 解:(1)该原电池中,锌易失电子发生氧化反应而作负极,电极反应式为:Zn-2e-=Zn2+,铜作正极,正极上氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑,
故答案为:Zn-2e-=Zn2+;2H++2e-=H2↑;
(2)负极上锌生成锌离子进入溶液而导致质量减少,正极上氢离子得电子生成氢气,所以正极质量不变,两个电极减少的质量是锌的质量,锌和稀硫酸反应离子方程式为2H++Zn=Zn2++H2↑,
根据锌和氢气之间的关系式得氢气的体积=$\frac{\frac{(60g-47g)}{65g/mol}}{1}$×22.4L/mol=4.48L,
故答案为:4.48.
点评 本题以原电池原理考查了氧化还原反应的有关计算,明确正负极上发生的反应是解本题关键,然后根据锌和氢气的关系式计算即可,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA | |
| B. | 0.1mol铁粉与足量水蒸气反应生成的H2分子数目为0.1NA | |
| C. | 由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 | |
| D. | 分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 半导体材料砷化镓 | B. | 透明陶瓷材料硒化锌 | ||
| C. | 吸氢材料镧镍合金 | D. | 超导材料K3C60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
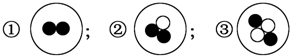
| A. | 它们是不同元素的原子 | B. | 它们单质的化学性质相同 | ||
| C. | 这三种原子具有不同的核电荷数 | D. | 这三种原子具有相同的质量数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2.“气化炉”中主要反应有:
科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2.“气化炉”中主要反应有:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
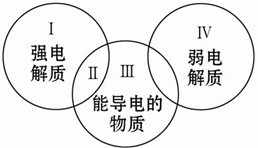 对下列物质:①镁 ②石墨 ③熔融氯化钠 ④盐酸 ⑤稀硫酸 ⑥氨水 ⑦白磷 ⑧硫酸钡 ⑨冰醋酸 ⑩二氧化碳,分类正确的是( )
对下列物质:①镁 ②石墨 ③熔融氯化钠 ④盐酸 ⑤稀硫酸 ⑥氨水 ⑦白磷 ⑧硫酸钡 ⑨冰醋酸 ⑩二氧化碳,分类正确的是( )| A. | Ⅰ包含的物质有③④⑤⑧ | B. | Ⅱ中包含的物质是③ | ||
| C. | Ⅲ中包含的物质是①②③⑤⑥⑧ | D. | Ⅳ中包含的物质是⑥⑨⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用合适的催化剂可以加快反应的速率 | |
| B. | 升高温度可以加快反应速率 | |
| C. | 减小压强能加快反应速率 | |
| D. | 增大N2浓度可以加快反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com