
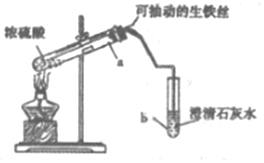
 某实验小组同学设计了如图装置,探究生铁与少置浓硫酸反应生成的气体产物.
某实验小组同学设计了如图装置,探究生铁与少置浓硫酸反应生成的气体产物.| A | B | C | D | E |
 |  |  |  |  |
分析 (1)探究生铁与少置浓硫酸反应生成的气体产物,连接好装置,检验气密性,加人试剂,加热a试管直到b中澄淸石灰水变浑浊,熄灭酒精灯,将生铁丝上提离开液面;
(2)b中的澄清石灰水变浑浊,甲同学认为产生的不一定是SO2气体,可能是生铁中碳和浓硫酸反应生成了二氧化碳;
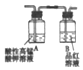
(3)①利用E装置进行反应,反应过程中产生SO2、CO2、H2三种气体,通过装置A中高锰酸钾溶液检验二氧化硫存在和除去二氧化硫,其中品红溶液是检验二氧化硫是否除净,通过装置C中澄清石灰水检验和除去二氧化碳气体,通过装置D中浓硫酸干燥气体,通过装置B检验氢气的存在;
②证明生成的气体中存在SO2的现象是高锰酸钾溶液变浅,二氧化硫具有还原性能还原酸性高锰酸钾;
(4)用2L0.3mol•L-1的NaOH溶液吸收标准状况下的11.2L的SO2气体生成的Na2SO3和NaHSO3的物质的量为x、y,结合元素守恒列式计算;
(5)忽略SO32-的二级水解,SO32-+H2O?HSO3-+OH-,水解平衡常数Kh=$\frac{c(HS{{O}_{3}}^{-})c(O{H}^{-})}{c(S{{O}_{3}}^{2-})}$=$\frac{c(HS{{O}_{3}}^{-})c(O{H}^{-})}{c(S{{O}_{3}}^{2-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{K{a}_{2}}$,据此计算;
解答 解:(1)探究生铁与少置浓硫酸反应生成的气体产物,连接好装置,检验气密性,加人试剂,加热a试管直到b中澄淸石灰水变浑浊,熄灭酒精灯,将生铁丝上提离开液面,该实验的操作依次是CAB,
故答案为:CAB;
(2)生铁中碳和浓硫酸加热反应生成了二氧化碳也可以使澄清石灰水变浑浊,b中的澄清石灰水变浑浊,不一定是二氧化硫,
故答案为:不同意;生铁中的碳与浓硫酸加热会生成CO2,CO2也能使澄清石灰水变浑浊;
(3)①利用E装置进行反应,反应过程中产生SO2、CO2、H2三种气体,通过装置A中高锰酸钾溶液检验二氧化硫存在和除去二氧化硫,其中品红溶液是检验二氧化硫是否除净,通过装置C中澄清石灰水检验和除去二氧化碳气体,通过装置D中浓硫酸干燥气体,通过装置B检验氢气的存在,装置的连接顺序是EACDB,
故答案为:EACDB;
②证明生成的气体中存在SO2的现象是:装置①中溶液紫红色变浅说明生成SO2 ,相应的离子方程式为:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,
故答案为:装置①中溶液紫红色变浅说明生成SO2;5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
(4)用2L0.3mol•L-1的NaOH溶液吸收标准状况下的11.2L的SO2气体生成的Na2SO3和NaHSO3的物质的量为x、y,氢氧化钠物质的量=2L×0.3mol•L-1=0.6mol,n(SO2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,
钠元素守恒:2x+y=0.6
硫元素守恒:x+y=0.5
x=0.1mol,
y=0.4mol,
生成的Na2SO3和NaHSO3的物质的量之比=0.1:0.4=1:4,
故答案为:1:4;
(5)忽略SO32-的二级水解,SO32-+H2O?HSO3-+OH-,水解平衡常数Kh=$\frac{c(HS{{O}_{3}}^{-})c(O{H}^{-})}{c(S{{O}_{3}}^{2-})}$=$\frac{c(HS{{O}_{3}}^{-})c(O{H}^{-})}{c(S{{O}_{3}}^{2-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{K{a}_{2}}$,
c2(OH-)=$\frac{Kw}{K{a}_{2}}$×0.1mol/L=$\frac{1{0}^{-14}}{1{0}^{-7.2}}$×01mol/L,
c(OH-)=10-3.9mol/L
c(H+)=$\frac{1{0}^{-14}}{1{0}^{-3.9}}$=10-10.1,
PH=10.1,
故答案为:10.1;
点评 本题考查了物质组成、物质含量测定、反应产物的实验验证和装置连接顺序,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
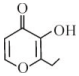
| A. | 该有机物的分子式为C7H7O3 | |
| B. | 1 mol该有机物只能与2 mol H2发生加成反应 | |
| C. | 该有机物在一定条件下能发生取代、氧化反应 | |
| D. | 该有机物的一种芳香族同分异构体能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成纤维和光导纤维都是新型有机非金属材料 | |
| B. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| C. | “玉不琢不成器”、“百炼方能成钢”发生的均为化学变化 | |
| D. | 造纸工艺中使用明矾,会导致纸张发生酸性腐蚀,使纸张变脆,易破损 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 验证Fe(NO3)2是否变质 | 将Fe(NO3)2溶于稀硫酸中,再滴加KSCN溶液,观察是否变化 |
| B | 制备Fe(OH)3胶体 | 向沸水中滴加饱和FeCl3溶液,加热并搅拌 |
| C | 证明氧化性H2O2比Fe3+强 | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
| D | 验证Ksp(AgI)<Ksp(AgCl) | 向AgCl的悬浊液中滴加KI溶液,出现黄色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
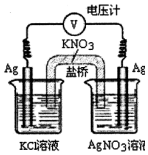 一定条件下,实验室利用如图所示装置,通过测电压求算Kkp(AgCl).工作一段时间后,两电极质量均增大.下列说法正确的是( )
一定条件下,实验室利用如图所示装置,通过测电压求算Kkp(AgCl).工作一段时间后,两电极质量均增大.下列说法正确的是( )| A. | 右池中的银电极作正极 | B. | 总反应为Ag++Cl-═AgCl | ||
| C. | 正极反应为Ag-e-═Ag+ | D. | 盐桥中的NO3-向右池方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2 | B. | HCOOH | C. | C6H12O6 | D. | C12H22O11 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 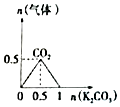 n (HCl)=1mol,K2CO3加入到HCl溶液中,在敝口容器中生成的气体 | |
| B. | 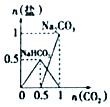 n(NaOH)=1mol,CO2通入到NaOH溶液中反应生成的盐 | |
| C. | 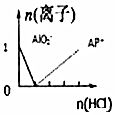 n(NaAlO2)=1mol,HCl加入到NaAlO2溶液中离子的存在情况 | |
| D. | 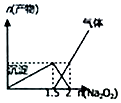 n(AlCl3)=1mol,Na2O2加入AlCl3溶液反应的产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com