
| A. | 检查容量瓶瓶口是否漏水的方法是:往瓶内加入一定量水,塞好瓶塞.用食指摁住瓶塞,另一只手托住瓶底,把瓶倒转过来,观察瓶塞周围是否有水漏出即可 | |
| B. | 向装有2mL 2mol/L AlCl3溶液的试管中,逐滴加入0.01mol/L氨水3mL,产生沉淀且沉淀不溶解,说明氢氧化铝不溶于弱碱 | |
| C. | 用浓硫酸配制一定浓度的稀硫酸时,用量筒量取浓硫酸倒入盛水的烧杯中稀释,并用水洗涤量筒,洗涤液一并倒入烧杯中 | |
| D. | 如果不慎将酸粘到皮肤或衣物上,立即用较多的水冲洗,再用3%~5%的NaHCO3溶液来冲洗 |
分析 A.用食指摁住瓶塞.另一只手托住瓶底.把瓶倒立过来.观察瓶塞周围是否有水漏出.如果不漏水.将瓶正支并将瓶塞旋转180°后塞紧;
B.AlCl3溶液过量;
C.配制一定浓度的稀硫酸使,不能洗涤量筒;
D.酸能和碱性物质反应生成中性物质.
解答 解:A.往瓶内加入一定量水.塞好瓶塞.用食指摁住瓶塞.另一只手托住瓶底.把瓶倒立过来.观察瓶塞周围是否有水漏出.如果不漏水.将瓶正支并将瓶塞旋转180°后塞紧.再把瓶倒立过来.再检查是否漏水,故A错误;
B.AlCl3溶液过量,氨水不足,不能说明氢氧化铝不溶于弱碱,故B错误;
C.配制一定浓度的稀硫酸使,不能洗涤量筒,否则会导致配制溶液浓度偏高,故C错误;
D.酸具有酸性和腐蚀性,能和弱碱性物质碳酸氢钠反应生成中性物质,所以如果不慎将酸粘到皮肤或衣物上,立即用较多的水冲洗,再用3%~5%的NaHCO3溶液来冲洗,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及基本操作、物质性质等知识点,明确实验原理及基本操作方法是解本题关键,注意基本操作规范性,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
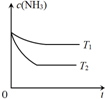 氨是一种重要的化工产品.
氨是一种重要的化工产品.| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂与还原剂的物质的量之比是2:1 | |
| B. | 当生成22.4LSO2气体时,转移的电子数目是2NA | |
| C. | 该反应写成离子式是Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$Cu+SO2↑+2H2O | |
| D. | 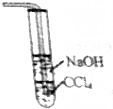 制备SO2装置尾气可用如图处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
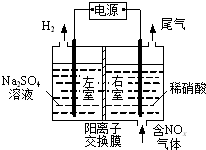 电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极).
电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸亚铁铵晶体过滤后用无水乙醇洗涤,阿司匹林晶体过滤后用冷水洗涤 | |
| B. | 最简式为C2H4O的有机物一定可以发生银镜反应 | |
| C. | 不粘锅表面的高分子涂层可以由四氟乙烯通过缩聚反应合成 | |
| D. | 甘油和甲苯只有在物质的量之比1:1混合时,充分燃烧后生成的水,才与等质量的甘油充分燃烧后生成的水相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的比例模型: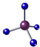 | B. | O2与O22-互为同分异构体 | ||
| C. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同素异形体 | D. | S2-的结构示意图: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com