
| A. | ${\;}_{46}^{102}$Pd和${\;}_{46}^{103}$Pd互为同位素 | |
| B. | 钯是第五周期元素 | |
| C. | Pd2+核外有48个电子 | |
| D. | ${\;}_{62}^{108}$Pd的原子核内有62个中子 |
分析 A.质子数相同,而质量数不同的原子,互为同位素;
B.Pd的原子序数为46,电子排布为[Kr]4d10;
C.Pd2+为阳离子,电子数=46-2;
D.中子数=质量数-质子数.
解答 解:A.${\;}_{46}^{102}$Pd和${\;}_{46}^{103}$Pd的质子数相同,均为46,但质量数不同,则中子数不同,二者互为同位素,故A正确;
B.Pd的原子序数为46,电子排布为[Kr]4d10,Kr为第四周期的稀有气体,则Pd为第五周期元素,故B正确;
C.Pd2+为阳离子,电子数=46-2,即Pd2+核外有44个电子,故C错误;
D.${\;}_{62}^{108}$Pd的原子核内有108-46=62个中子,故D正确;
故选C.
点评 本题考查元素周期表的结构及应用,把握原子序数及元素在周期表的位置、原子的构成、同位素的判断为解答的关键,注重基础知识的考查,选项B为解答的难点,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
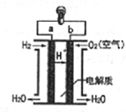
| A. | b极是负极 | B. | 正极发生氧化反应 | ||
| C. | a极的电极反应是H2-2e-=2H+ | D. | 该电池工作时,有淡蓝色火焰产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
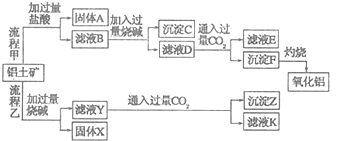
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30℃,块状锌与2 mol•L一1硫酸溶液反应 | |
| B. | 30℃,粉末状铁与2 mol•L一1硫酸溶液反应 | |
| C. | 60℃,粉末状锌与2 mol•L一1硫酸溶液反应 | |
| D. | 60℃,粉末状镁与2mol•L一1硫酸溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3胶体 | B. | Fe(OH)3沉淀 | C. | FeCl3溶液 | D. | 油水混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1 mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 在0.1 mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol•L-1]:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
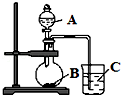 某研究性学习小组设计了一组实验,验证元素周期律.
某研究性学习小组设计了一组实验,验证元素周期律.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
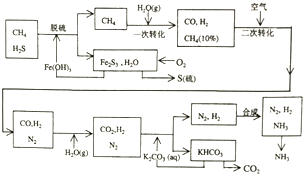
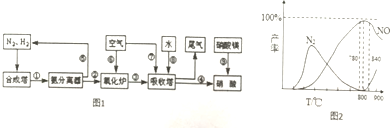
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com