
分析 (1)根据高锰酸钾在不同的条件下发生的反应的现象分析,不同环境中反应后的离子颜色不同,结合溶液酸碱性判断;
(2)得电子化合价降低的微粒发生还原反应,标注元素化合价的升高降低来判断;
(3)同一氧化还原反应中氧化剂的氧化性大于还原产物的氧化性;
(4)根据氧化还原反应中得失电子数相等配平方程式,并注意也要遵循原子守恒,该反应中,高锰酸钾是氧化剂,一个高锰酸钾化学式得5个电子,硫化钾是还原剂,K2SO4和S的物质的量之比为3:2,所以硫化钾生成硫酸钾和硫单质失去的电子数是28个电子,所以得失电子的最小公倍数是140,所以高锰酸钾的计量数是25,硫化钾的计量数是5;根据硫单质和转移电子之间的关系式计算转移电子数.
解答 解:(1)根据反应式知,不同环境中反应后的离子颜色不同,溶液的酸碱性不同溶液的颜色不同,所以溶液的颜色受溶液酸碱性的影响,
故答案为:酸碱性;
(2)二氧化硫含有还原性,酸性条件下,高锰酸根离子得电子生成二价锰离子,所以高锰酸根离子有强氧化性,所以还原反应的过程为MnO4-→Mn2+,
故答案为:MnO4-;Mn2+;
(3)同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性,将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色,说明PbO2氧化二价锰离子生成高锰酸根离子,所以PbO2作氧化剂,高锰酸根离子是氧化产物,所以PbO2的氧化性大于高锰酸根离子;
故答案为:a;
(4)①该反应中,高锰酸钾是氧化剂,一个高锰酸钾化学式得5个电子,硫化钾是还原剂,K2SO4和S的物质的量之比为3:2,所以硫化钾生成硫酸钾和硫单质失去的电子数是28个电子,所以得失电子的最小公倍数是140,所以高锰酸钾的计量数是28,硫化钾的计量数是5,其它元素根据原子个数相等配平,所以方程式为:28KMnO4+5K2S+24KOH=28K2MnO4+3K2SO4+2S↓+12H2O;
故答案为:28;5;24KOH;28;3;2;12H2O;
②标注化学反应的电子转移计算反应电子转移总数;
反应过程中电子转移总数为28e-,若生成6.4 g单质硫,设转移电子数是x,依据化学方程式定量关系计算
28KMnO4+5K2S+24KOH=28K2MnO4+3K2SO4+2S↓+12H2O 转移电子
2mol 28NA
$\frac{6.4g}{32g/mol}$ x
x=2.8NA
故答案为:2.8NA.
点评 本题考查了有关物质的量的计算、氧化性和还原性的判断等知识点,难度中等,明确氧化性和还原性强弱的判断方法,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 熔点:Na>MgO>SiO2 | B. | 水溶性:SO2>H2S>HCl | ||
| C. | 热稳定性:HF>H2O>NH3 | D. | 沸点:HF>HCl>HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)2CHCl | B. | CH3C(CH3)2I | C. | (CH3)3COOCCH2CH3 | D. | CH3C(CH3)2CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 离子方程式 | |
| A |  | 在空气中放置一段时间后,溶液呈蓝色 | 4H++4I-+O2═2I2+2H2O |
| B | 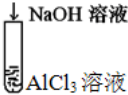 | 溶液由先浑浊后澄清 | Al3++3OH-═Al(OH)3↓ Al(OH)3+OH-═AlO2-+2H2O |
| C | 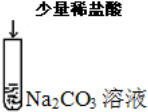 | 溶液中无气泡产生 | CO22-+H+=HCO3-+H2O |
| D |  | 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新戊烷 C(CH3)4 | B. | 3-乙基-1-丁烯 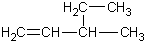 | ||
| C. | 2-甲基-2,4-己二烯 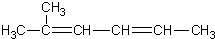 | D. | 2,2,3-三甲基戊烷 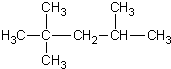 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
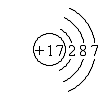
| A. | E(3s)>E(3p)>E(3d) | B. | E(3s)>E(2s)>E(2 p) | C. | E(4f)>E(3d)>E(4s) | D. | E(5s)>E(4s)>E(4f) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子式为C2H4O2的有机化合物性质相同 | |
| B. | 由如图可得H2O2分解的热化学方程式为2H2O2(aq)═2H2O(l)+O2(g),△H=(E1-E2)kJ•mol-1 | |
| C. | Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 | |
| D. | Na2O2与CO2反应产生1 mol O2理论上转移的电子数约为26.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com