
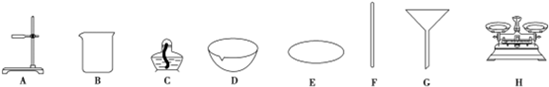
分析 对一粗盐样品进行初步提纯,提纯的步骤是溶解、过滤、蒸发.过滤操作中的“二低”是:滤纸上沿低于漏斗边缘;液面低于滤纸上沿,结合图分析仪器的名称,以此来解答.
解答 解:(1)由图可知,仪器B、C、D、F、G、H分别为烧杯、酒精灯、蒸发皿、玻璃棒、漏斗、托盘天平,
故答案为:烧杯;酒精灯;蒸发皿;玻璃棒;漏斗;托盘天平;
(2)提纯的步骤是:溶解、过滤、蒸发,故答案为:蒸发;
(3)过滤操作中的“二低”是:滤纸上沿低于漏斗边缘;液面低于滤纸上沿,故答案为:滤纸上沿低于漏斗边缘、液面低于滤纸上沿.
点评 本题考查混合物分离提纯,为高频考点,把握仪器的使用、粗盐提纯实验为解答的关键,侧重分析与实验能力的考查,注意过滤操作及注意事项,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
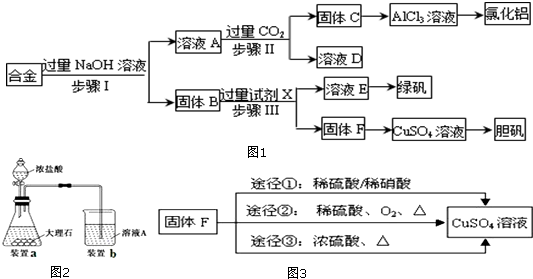
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜是过渡金属元素,可以形成多种化合物.
铜是过渡金属元素,可以形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③①⑤④ | B. | ①②③⑤④ | C. | ③①②④⑤ | D. | ①⑤②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
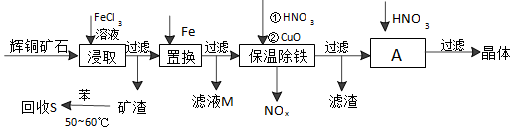
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com