
| A. | SiO2+2NaOH═Na2SiO3+H2O | B. | H2SiO3$\frac{\underline{\;\;△\;\;}}{\;}$SiO2+H2O | ||
| C. | Na2SiO3+CO2+H2O═H2SiO3+Na2CO3 | D. | SiO2+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑ |
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4 | B. | CO2+C$\frac{\underline{\;\;△\;\;}}{\;}$2CO | ||
| C. | NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O↑+CO2↑ | D. | CaCO3+CO2+H2O═Ca(HCO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 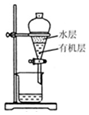 用如图装置分离有机 层与水层,水层从分液 漏斗下口放出 | |
| B. | 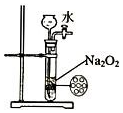 用如图装置可用来制 备少量氧气,并且控制 反应的发生与停止 | |
| C. | 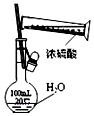 如图中配制一定物质的量浓度的硫酸溶液不能 直接在容量瓶中进行 | |
| D. | 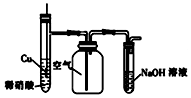 用如图装置制备并收集NO气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
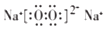 (用电子式表示).
(用电子式表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是酸性氧化物不跟任何酸反应 | |
| B. | 水玻璃敞口存放,能有白色胶状沉淀析出 | |
| C. | 高温时SiO2能跟Na2CO3反应放出CO2,所以硅酸的酸性比碳酸强 | |
| D. | SiO2和CO2化学性质虽然相似,且两者的结构完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
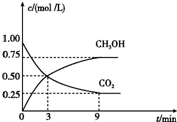 中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com