
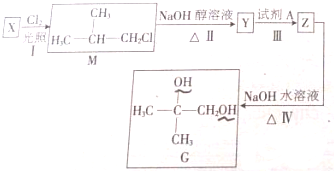

分析 X和氯气发生取代反应生成M,根据M结构简式知,X结构简式为CH3CH(CH3)2,M发生消去反应生成Y,Y结构简式为CH3C(CH3)=CH2,Y和A反应生成Z,Z水解生成G,根据G结构简式知,A为溴,Z为CH3C(CH3)BrCH2Br,结合题目分析解答.
解答 解:X和氯气发生取代反应生成M,根据M结构简式知,X结构简式为CH3CH(CH3)2,M发生消去反应生成Y,Y结构简式为CH3C(CH3)=CH2,Y和A反应生成Z,Z水解生成G,根据G结构简式知,A为溴,Z为CH3C(CH3)BrCH2Br,
(1)X结构简式为CH3CH(CH3)2,X的名称是2-甲基丙烷;Z为CH3C(CH3)BrCH2Br,Z的分子式为C4H8Br2,
故答案为:2-甲基丙烷;C4H8Br2;
(2)通过以上分析知,Y的结构简式为CH3C(CH3)=CH2,故答案为:CH3C(CH3)=CH2;
(3)醇羟基能和Na反应生成氢气,该分子中含有两个氢键,所以1molG与足量的钠反应生成的氢气是1mol,Ⅰ反应类型是取代反应,故答案为:1;取代反应;
(4)Y结构简式为CH3C(CH3)=CH2,Z为CH3C(CH3)BrCH2Br,Y和溴发生加成反应生成Z,反应Ⅲ的化学反应式:CH3C(CH3)=CH2+Br2→CH3C(CH3)BrCH2Br,
故答案为:CH3C(CH3)=CH2+Br2→CH3C(CH3)BrCH2Br;
(5)E是M的同分异构体,如果主链上有4个碳原子,其同分异构体有2种,如果主链上有3个碳原子,有两种同分异构体(包含M),所以E有三种;其中在核磁共振氢谱上只有一个峰的结构简式为CH3CCl(CH3)3,
故答案为:3;CH3CCl(CH3)3.
点评 本题考查有机物推断,侧重考查学生分析推断能力,根据反应条件、部分物质结构简式进行推断,知道常见有机物反应类型及反应条件,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 加热 | B. | 滴加少量的CuSO4溶液 | ||
| C. | 不用稀硫酸,改用98%浓硫酸 | D. | 不用铁片,改用铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化氮 | B. | 二氧化硫 | ||
| C. | 一氧化氮 | D. | 甲醛和苯、甲苯等有机物气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.15mol/(L•min) | B. | v(B)=0.6mol/(L•min) | ||
| C. | v(C)=0.4mol/(L•min) | D. | v(D)=0.0075 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④>①>②>③>⑤ | B. | ②>①>④>③>⑤ | C. | ③>①>④>②>⑤ | D. | ①>④>②>③>⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由Cu、Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2gH2,则电路通过电子0.4NA | |
| B. | 18gD2O中含有的质子数目为10NA | |
| C. | 1molCl2发生反应时,转移的电子数一定是2NA | |
| D. | 常温常压下,16gO3所含的原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一个小黑点表示一个电子 | B. | 黑点的多少表示电子个数的多少 | ||
| C. | 表示电子运动的轨迹 | D. | 电子在核外空间出现机会的多少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 描述 | 解释或结论 |
| A | 向某溶液中加入BaCl2溶液生成白色沉淀,继续加稀硝酸沉淀不消失 | 溶液中含SO42- |
| B | Cl2+H2O=HClO+HCl | Cl2仅为还原剂,HCl为氧化产物 |
| C | PH=1的溶液中Fe2+、Al3+、SO42-、MnO4-不能大量共存 | 5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O |
| D | SO2使酸性高锰酸钾溶液和品红试液褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com