
| A.NaH中存在-1价的氢离子,还原性比氢原子强 |
| B.NaH与H2O反应时水作氧化剂,反应放出热量 |
| C.NaH中氢元素的离子的电子层排布与氦原子的电子层排布相同 |
| D.微粒半径:H+>H>H- |
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源:不详 题型:单选题
| | NaCl | MgCl2 | AlCl3 | SiCl4 | 单质B |
| 熔点(℃) | 801 | 714 | 190 | —70 | 2300 |
| 沸点(℃) | 1413 | 1412 | 180 | 57.57 | 2500 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:判断题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 、L、M五种元素的原子序数依次增大。X、Y是组成有机物的基本元素,Z的最外层电子分布情况是P轨道上的电子比S轨道上的电子多一个,L在所有元素中电负性排第二位,其原子最外层有两个未成对电子,M的正三价离子其核外第三电子层有五个未成对电子。回答下列问题:
、L、M五种元素的原子序数依次增大。X、Y是组成有机物的基本元素,Z的最外层电子分布情况是P轨道上的电子比S轨道上的电子多一个,L在所有元素中电负性排第二位,其原子最外层有两个未成对电子,M的正三价离子其核外第三电子层有五个未成对电子。回答下列问题:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.离子晶体中可能含有共价键,但不一定含有金属元素 |
| B.分子晶体中一定含有共价键 |
| C.非极性分子中一定存在非极性键 |
| D.对于组成结构相似的分子晶体,一定是相对分子质量越大,熔沸点越高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 经催化剂作用变成N2和CO
经催化剂作用变成N2和CO 2,此反应中三种元素第一电离能由小到大的顺序为 ,在这四种物质中含有极性键的非极分子内
2,此反应中三种元素第一电离能由小到大的顺序为 ,在这四种物质中含有极性键的非极分子内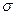 键和
键和 键的比为 。
键的比为 。| A.氢键 | B.离子键 | C.共价键 | D.配位键[E.范德华力 |
 对,则[Cu(NH3)n]+中n的值为
对,则[Cu(NH3)n]+中n的值为  。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.分子中 N-Cl键是非极性键 | B.分子中不存在孤对电子 |
| C.三氯化氮分子结构呈三角锥形 | D.因N-Cl 键键能大,它的沸点高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构 |
| B.NaCl与CsCl化学式相似,故NaCl与CsCl的晶体结构也相似 |
| C.苯不能使酸性高锰酸钾溶液褪色,故苯的同系物也不能使酸性高锰酸钾溶液褪色 |
| D.CO2通入Ca(ClO)2溶液生成CaCO3和HClO,SO2通入Ca(ClO)2溶液也生成CaSO3和HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com