
| A. | pH=3的盐酸和pH=5的硫酸等体积混合,pH=4 | |
| B. | 室温下,pH=9的碱性溶液中,可能存在CH3COOH分子 | |
| C. | 中性溶液中必然有c(H+)=c(OH-)=1×10-7 mol/L | |
| D. | 在0.1 mol/L HCl溶液中加入适量的蒸馏水,溶液中各种离子的物质的量浓度均减小 |
分析 A、酸溶液混合,先计算混合后溶液中氢离子的物质的量,再根据c=$\frac{n}{V}$计算氢离子的物质的量浓度,最后根据pH=-lgc(H+)计算出混合液的pH;
B、CH3COONa溶液中由于水解可存在少量的CH3COOH分子;
C、中性溶液中c(H+)=c(OH-),但数值不一定等于1×10-7 mol/L,于温度有关;
D、酸溶液稀释后c(H+)减小,c(OH-)必然增大.
解答 解:A、pH=3的盐酸和pH=5的硫酸等体积混合后,设体积均为VL,混合液中氢离子的物质的量为:n(H+)=VL×10-3mol/L+VL×10-5mol/L≈10-3Vmol,则混合溶液中氢离子浓度为:c(H+)=$\frac{1{0}^{-3}Vmol}{2VL}$=5×10-4mol/L,所以pH=-lg5×10-4=4-lg5=3.3,故A错误;
B、CH3COONa溶液显碱性,由于水解可存在少量的CH3COOH分子,故B正确;
C、中性溶液中c(H+)=c(OH-),但数值不一定等于1×10-7 mol/L,于温度有关,故C错误;
D、酸溶液稀释后c(H+)减小,c(OH-)必然增大,故D错误;
故选B.
点评 本题考查了pH的计算、盐类水解、溶液稀释过程中各离子浓度变化,题目难度不大.


科目:高中化学 来源: 题型:解答题
 CH3COOC2H5+H2O.其中浓H2SO4的作用是催化剂和吸水剂
CH3COOC2H5+H2O.其中浓H2SO4的作用是催化剂和吸水剂
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
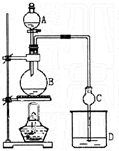 某课外小组设计的实验室制取乙酸乙酯的装置如图所示. 已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点如下表:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示. 已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点如下表:| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
 CH3CO18OCH2CH3+H2O.
CH3CO18OCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和Na2CO3溶液 | B. | CaCl2溶液 | C. | Na2SiO3溶液 | D. | Ca(ClO)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,4g CH4含有NA个C-H共价键 | |
| B. | 1 mol Fe与过量的稀硝酸反应过程中转移的电子数为2NA | |
| C. | 常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
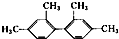 的烃,下列说法中正确的是( )
的烃,下列说法中正确的是( )| A. | 该烃属于苯的同系物 | |
| B. | 分子中至少有16个碳原子处于同一平面上 | |
| C. | 分子中至少有9个碳原子处于同一平面上 | |
| D. | 分子中至少有11个碳原子处于同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IVA族元素氢化物熔点顺序是:GeH4>SiH4>CH4;则VA族元素氢化物熔点顺序也是:AsH3>PH3>NH3 | |
| B. | 第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3;则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 | |
| C. | 工业上用电解氯化镁制备镁单质,工业上也可用电解氯化铝制备铝单质 | |
| D. | Fe3O4可改写成氧化物的形式为:FeO•Fe2O3;因此Pb3O4也可改写为:PbO•Pb2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性 | |
| B. | SO2溶于水,其水溶液能导电,说明SO2是电解质 | |
| C. | 石墨转化为金刚石的反应是吸热反应,说明等量的石墨比金刚石能量高 | |
| D. | 某溶液用盐酸酸化无明显现象,再滴加氯化钡溶液有白色沉淀产生,说明溶液中有SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com