
| t/min | 0 | 20 | 40 | 60 | 80 | 120 | |
| 第一次试验 | x(HI) | 1 | 0.90 | 0.85 | 0.815 | 0.795 | 0.784 |
| 第二次试验 | x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
分析 (1)表中第一列,由HI分解建立平衡,表中第二列向逆反应进行建立平衡,由第一列数据可知,平衡时HI物质的量分数为0.784,则氢气、碘蒸汽总物质的量分数为1-0.784=0.216,而氢气、与碘蒸汽物质的量分数相等均为0.108,反应前后气体体积不变,用物质的量分数代替浓度代入平衡常数表达式K=$\frac{c({H}_{2})c({I}_{2})}{{c}^{2}(HI)}$计算;
(2)到达平衡时,正、逆反应速率相等,结合平衡常数表达式,可知k逆的表达式;在t=40min时,x(HI)=0.85,代入正反应速率表达式v正=k正x2(HI)计算.
解答 解:(1)表中第一列,由HI分解建立平衡,表中第二列向逆反应进行建立平衡,由第一列数据可知,平衡时HI物质的量分数为0.784,则氢气、碘蒸汽总物质的量分数为1-0.784=0.216,而氢气、与碘蒸汽物质的量分数相等均为0.108,反应前后气体体积不变,用物质的量分数代替浓度计算平衡常数,则平衡常数K=$\frac{c({H}_{2})c({I}_{2})}{{c}^{2}(HI)}$=$\frac{0.108×0.108}{078{4}^{2}}$,
故答案为:$\frac{0.108×0.108}{078{4}^{2}}$;
(2)到达平衡时,正、逆反应速率相等,则k正x2(HI)=k逆x(H2)x(I2),则k逆=k正×$\frac{{x}^{2}(HI)}{x({H}_{2})x({I}_{2})}$=$\frac{{K}_{正}}{K}$,
在t=40min时,正反应建立平衡的x(HI)=0.85,则v正=k正x2(HI)=0.0027min-1×0.852=1.95×10-3min-1,
故答案为:$\frac{{K}_{正}}{K}$;1.95×10-3.
点评 本题比较综合,题目难度中等,涉及化学平衡常数计算、化学反应速率计算及影响因素、平衡移动等,属于综合型题目,侧重考查学生自学能力、分析解决问题的能力,注意表中数据为不同方向建立的平衡,题目中没有明确,增大题目难度.


科目:高中化学 来源: 题型:选择题
| A. | 用pH数据推测相同浓度的不同强酸弱碱盐在水溶液中水解程度的大小 | |
| B. | 用反应热数据的大小判断不同反应反应速率的快慢 | |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| D. | 用平衡常数的大小判断化学反应可能进行的程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铜丝表面有气泡产生 | |
| B. | 铁钉上发生的反应为:Fe-3e-═Fe3+ | |
| C. | 一段时间后铁钉上出现红色物质 | |
| D. | 如果把铜丝换成镁条,会加快铁钉的溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500mL溶液中所含K+、SO42-总数为0.3NA | |
| B. | 500mL溶液中含有0.1NA个K+离子 | |
| C. | 1L溶液中K+离子浓度是0.2mol/L | |
| D. | 2L溶液中SO42-离子浓度是0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol/LNaHCO3溶液中:Al3+、NH4+、SO42-、NO3- | |
| B. | 常温下,$\frac{{K}_{W}}{c({H}^{+})}$=0.1mol/L的溶液中:K+,Cl-,Fe2+,NO3- | |
| C. | 使甲基橙变红的溶液中:NH4+,Cl-,SO2-,Mg2+ | |
| D. | 25℃时,水电离出的c(H+)=1×10-13mol/L:K+,Ba2+,NO3-,S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用50mL量筒量取2.35mL稀硫酸 | |
| B. | 用托盘天平称5.56gKCl固体 | |
| C. | 配制100mlL浓度为1 mol/L的食盐水需称食盐5.9g | |
| D. | 用酒精可以萃取碘水中的碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
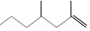 (2,4-二甲基-1-庚烯),
(2,4-二甲基-1-庚烯),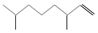 (3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)8CH═CH-CH═CH(CH2)8CH3.下列说法不正确的是( )
(3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)8CH═CH-CH═CH(CH2)8CH3.下列说法不正确的是( )| A. | 2,4-二甲基1庚烯的分子式为C9H18 | |
| B. | 2,4-二甲基-1-庚烯与3,7-二甲基-1-辛烯互为同系物 | |
| C. | 以上三种信息素均能使溴的四氯化碳溶液褪色 | |
| D. | 1 mol家蚕的性信息素与1 mol Br2加成,产物只有一种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com