
分析 (1)工业上用石灰乳与氯气反应制取漂白粉,二者反应生成氯化钙、次氯酸钙和水;
(2)漂白粉溶液中滴加碳酸钠溶液生成碳酸钙白色沉淀,检验漂白精中的氯离子,应先加硝酸酸化,再滴加硝酸银检验;
(3)漂白粉能够与空气中的二氧化碳反应生成次氯酸,次氯酸具有不稳定性,见光易分解.
解答 解:(1)氯气与氢氧化钙反应制备漂白粉,则漂白粉的主要成分为Ca(ClO)2、CaCl2,有效成分为Ca(ClO)2,工业上制取漂白粉的化学方程式为:2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O,
故答案为:2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O;
(2)将漂白粉溶于适量水中,呈白色浊状物,静置沉降.取少许上层清液,滴加碳酸钠溶液,碳酸钠电离出的碳酸根离子和溶液中的钙离子发生反应:CaCl2+Na2CO3═CaCO3↓+2NaCl,出现白色碳酸钙沉淀,反应的离子方程式为:Ca2++CO32-═CaCO3↓,检验漂白精中的氯离子,应先加HNO3酸化,再滴加AgNO3溶液,发生CaCl2+2AgNO3═2AgCl↓+Ca(NO3)2,观察到白色沉淀,则说明Cl-存在,反应的离子方程式为:Cl-+Ag+═AgCl↓,
故答案为:Ca2++CO32-═CaCO3↓;AgNO3、HNO3;Cl-+Ag+═AgCl↓;
(3)漂白粉在空气中长期放置失效是因为漂白粉能够与空气中的二氧化碳反应生成次氯酸,次氯酸具有不稳定性,见光易分解,化学方程式:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO、2HClO $\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑;
故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO、2HClO $\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑.
点评 本题考查氯气的化学性质及氯离子的检验、化学反应和离子反应的书写,明确发生的化学反应为解答的关键,侧重基础知识的考查,注意物质的性质及反应,题目难度不大.


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:实验题
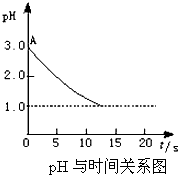 某课题小组的同学对“电解氯化铜溶液时的pH变化”的问题,有以下两种不同的观点:
某课题小组的同学对“电解氯化铜溶液时的pH变化”的问题,有以下两种不同的观点:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH2+HCl $→_{△}^{催化剂}$CH3CH2Cl | |
| B. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| C. | 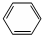 +Br2 $\stackrel{FeBr_{3}}{→}$ +Br2 $\stackrel{FeBr_{3}}{→}$ 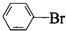 +HBr +HBr | |
| D. | CH3CH2 Br+NaOH $→_{△}^{乙醇}$ CH2=CH2↑+Na Br+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 | ① | Fe2+具有还原性 |
| ② | 在FeCl2溶液中加入锌片 | / | Zn+Fe2+=Zn2++Fe | ② |
| ③ | 在FeCl3溶液中加入足量铁粉 | ③ | Fe+2Fe3+=3Fe2+ | Fe3+具有氧化性 |
| ④ | ④ | / | / | Fe3+具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
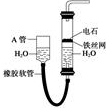 用图中的实验装置制取乙炔.
用图中的实验装置制取乙炔.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
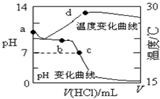 室温下,将1.000mol/L盐酸滴入20.00mL1.000mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol/L盐酸滴入20.00mL1.000mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | a点由水电离出的c(H+)=1.0×10-14mol/L | |
| B. | b点时c(NH4+)+c(NH3•H2O)=c(Cl-) | |
| C. | c点时消耗的盐酸体积:V(HCl)<20.00mL | |
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com