
| A. | C生成的速率与C分解的速率不相等 | |
| B. | A、B、C的浓度不再变化 | |
| C. | 单位时间生成nmolA,同时生成3nmolB | |
| D. | A、B、C的分子数之比为1:3:2 |
分析 判断一个反应是否处于平衡状态的主要依据为:①判断v(正)与v(逆)是否相等;②反应物和生成物的浓度是否不随时间的变化而变化,据此进行解答.
解答 解:A.C生成的速率与C分解的速率不相等,说明v(正)≠v(逆),该反应没有达到平衡状态,故A错误;
B.A、B、C的浓度不再变化,说明正逆反应速率相等,该反应达到平衡状态,故B正确;,
C.在任何时刻,有nmolA产生时必有3nmolB同时产生,两者表示的都是逆反应速率,无法判断正逆反应速率是否相等,故C错误;
D.A、B、C的分子数之比为1:3:2,无法判断各组分的浓度是否不再变化,则无法判断该反应是否达到平衡状态,故D错误;
故选B.
点评 本题考查了化学平衡状态的判断,题目难度不大,明确化学平衡状态的特征为解答关键,注意掌握判断化学平衡状态的依据,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 向0.1 mol•L-1的醋酸溶液中加水或通入HCl气体都能使$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值增大 | |
| B. | 0.1 mol•L-1的醋酸钠溶液20 mL与0.1 mol•L-1盐酸10 mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | 等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c (Na+)═c (SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 0.1 mol•L-1某一元酸HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-8,则该溶液中由水电离出的c(H+)=1×10-11mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [Cl-]>[NH4+]>[H+]>[OH-] | B. | [Cl-]>[H+]>[NH4+]>[OH-] | C. | [NH4+]>[OH-]>[Cl-]>[H+] | D. | [OH-]>[H+]>[Cl-]>[NH4+] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L H2O含有NA个分子 | |
| B. | 1L 1mol•L -1的NaClO 溶液中含有ClO-的数目少于NA个 | |
| C. | 0.1molAlCl3完全转化为氢氧化铝胶体,生成0.l NA个胶体粒子 | |
| D. | 0.1molCl2与足量NaOH溶液反应,转移电子数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | NaOH/mol•L-1 | HA/mol•L-1 | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- | |
| B. | 氯气与水的反应:Cl2+H2O=2H++Cl-+ClO- | |
| C. | 铜片跟稀硝酸反应:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O | |
| D. | 铝片和氢氧化钠溶液反应:Al+OH-+6H2O=[Al(OH)4]-+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
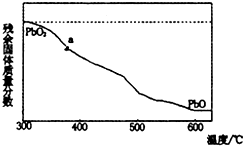 (1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3
(1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3查看答案和解析>>
科目:高中化学 来源: 题型:实验题
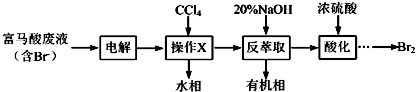
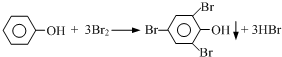
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 操作 | 结论 |
| A | 配制FeCl2溶液时加入适量的盐酸 | 抑制Fe2+水解 |
| B | 浓硫酸和蔗糖反应产生的气体通过足量的KMnO4溶液,气体全部被吸收且溶液紫红色褪去 | “黑面包实验”产生的气体具有还原性 |
| C | 制备乙酸乙酯的实验,将蒸出的乙酸乙酯蒸汽导在饱和的NaOH溶液液面以上 | 防止倒吸,便于分层. |
| D | 幼儿使用含NaF的牙膏,可以使牙齿上的Ca5(PO4)3OH转化为Ca5(PO4)3F,防止蛀牙 | Ksp[Ca5(PO4)3F]<Ksp[Ca5(PO4)3OH] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com