
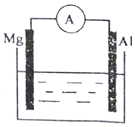
 正确认识和使用电池有利于我们每一个人的日常生活如图所示装置中:
正确认识和使用电池有利于我们每一个人的日常生活如图所示装置中:分析 图示为原电池装置,结合电解质溶液和自发进行的氧化还原反应判断原电池负极,书写电极反应和电池反应,
(1)若烧杯中溶液为稀硫酸,镁为负极,铝为正极,正极反应为氢离子得到电子发生还原反应;
(2)若烧杯中溶液为氢氧化钠溶液,铝为负极,镁为正极,电池反应为铝和氢氧化钠溶液的反应;
解答 解:(1)若烧杯中溶液为稀硫酸,镁为负极,铝为正极,正极反应为氢离子得到电子发生还原反应,电极反应为:2H++2e-=H2↑,
故答案为:2H++2e-=H2↑;
(2)若烧杯中溶液为氢氧化钠溶液,铝为负极,电极反应为:Al-3e-+4OH-=[Al(OH)4]-,镁为正极,电极反应为2H2O+2e-=H2↑+2OH-,装置中总反应方程式为:2Al+2NaOH+6H2O=2Na[Al(OH)4]+2H2↑,
故答案为:Al;2Al+2NaOH+6H2O=2Na[Al(OH)4]+2H2↑;
点评 本题原电池原理、电极反应书写、电池的分析应用等知识点,为高频考点,明确电极反应式的书写方法是解本题关键,书写电极反应式要结合电解质溶液酸碱性,题目难度不大.


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无水硫酸铜粉末遇水变蓝色 | |
| B. | 氢氧化铁胶体使水中悬浮物聚沉 | |
| C. | 盛在无色试剂瓶中的浓硝酸呈黄色 | |
| D. | FeSO4溶液久置于空气中,溶液呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6 LNO和5.6LO2混合后的分子总数为0.5 NA | |
| B. | 1mol乙烷分子含有8NA个共价键 | |
| C. | 58.5 g氯化钠固体中含有NA个氯化钠分子 | |
| D. | 标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | (1)(2)(3)(4) | C. | (1)(2)(3) | D. | (2)(3)(4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验②证明了①的滤液中含有Ag+,由此推断①的滤液中也含有Cl- | |
| B. | 实验②证明了Kap(AgCl)<Kap(Ag2SO4) | |
| C. | 实验③的溶液中含有+微粒 | |
| D. | 由实验③推测:若在①的沉淀中滴加NaOH溶液,沉淀也能溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | NaOH溶液 | 醋酸 | 盐酸 |
| A. | ③④中分别加入适量醋酸钠晶体,两溶液pH均增大 | |
| B. | ①与②两溶液中:c(NH4+)>c(Na+) | |
| C. | 分别加水稀释10倍,溶液的pH:①>②>④>③ | |
| D. | V1L①和V2L④溶液混合后,若pH=7,则V1>V2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com