


| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、浊液的分散质可用过滤的方法从分散剂中分离开来 |
| B、任何物质在水中溶解时都有一定的溶解度 |
| C、淀粉溶液属于分散系中的溶液 |
| D、分散质粒子大小为几纳米到几十纳米的分散系是胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X>M>Y>N |
| B、X>M>N>Y |
| C、M>N>Y>X |
| D、M>X>Y>N |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X与Y形成化合物时,X显负价,Y显正价 |
| B、第一电离能Y一定小于X |
| C、最高价含氧酸的酸性:X对应的酸性强于Y对应的酸性 |
| D、气态氢化物的稳定性:HmY小于HmX |
查看答案和解析>>
科目:高中化学 来源: 题型:
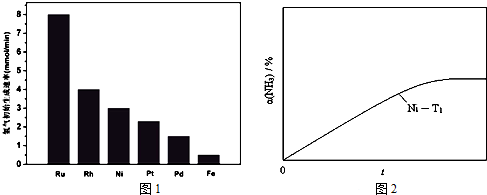
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,用0.10mol?L-1 KOH溶液滴定10.00mL 0.10mol?L-1某二元弱酸H2R溶液所得滴定曲线如图(混合溶液总体积可看成混合前两种溶液体积之和).下列关系正确的是( )
常温下,用0.10mol?L-1 KOH溶液滴定10.00mL 0.10mol?L-1某二元弱酸H2R溶液所得滴定曲线如图(混合溶液总体积可看成混合前两种溶液体积之和).下列关系正确的是( )| A、点②所示溶液中:c(K+)+c(H+)=c(HR-)+c(R2-)+c(OH-) |
| B、点③所示溶液中:c(K+)>c(HR-)>c(H2R)>c(R2-) |
| C、点④所示溶液中:c(H2R)+c(HR-)+c(R2-)=0.04 mol/L |
| D、点⑤所示溶液中:c(H+)=c(HR-)+2c(H2R)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.25mol |
| B、0.2mol |
| C、0.15mol |
| D、0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
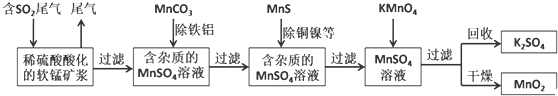
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com