
 用电化学原理研究金属铝具有重要的意义.
用电化学原理研究金属铝具有重要的意义.| 3 |
| 2 |
| 高温 |
| 3 |
| 2 |
| 1600 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 1600 |
| 2 |
| 800 |
| 1000 |
| 3 |
| 2 |


科目:高中化学 来源: 题型:
| A、同周期元素的原子半径以ⅦA族的为最大 |
| B、在周期表中零族元素的单质不全部是气体 |
| C、ⅠA、ⅡA族元素的原子,其半径越大越容易失去电子 |
| D、所有主族元素的原子形成单原子离子时的最高价数都和它的族数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 RCOOH+CO2↑②
RCOOH+CO2↑②

查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电过程中,Li向负极区移动 |
| B、正极的电极反应式:LixC6+xe-=xLi+Li1-xC6 |
| C、电子流动方向:负极→外电路→正极→有机电解液→负极 |
| D、充电时阳极电极反应式:LiCoO2-xe-=Li1-xCoO2+x Li |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 乙 |
| 乙 |
| 甲 |
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 甲 | Fe | O2 | HNO3 | H2S | NaOH | KOH |
| 乙 | Cl2 | C | Fe | O2 | AlCl3 | SO2 |
| 丙 | FeCl3 | CO2 | Fe(NO2)3 | S | Al(OH)3 | K2SO3 |
| 丁 | FeCl2 | CO | Fe(NO3)2 | SO2 | NaAlO2 | KHSO2 |
| A、只有①②③④ |
| B、只有②③④⑥ |
| C、只有③④⑤⑥ |
| D、只有②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤ | B、①③④⑤ |
| C、①③⑤ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 发现年代 | 1971年 | 1976年 | 1977年 | 1978年 | 1982年 |
| 星际分子 | 氰基乙炔 (HC3N) | 氰基丁二炔 (HC5N) | 氰基已三炔 (HC7N) | 氰基辛四炔 (HC9N) | 氰基癸五炔 (HC11N) |
| A、五种氰基炔互为同素异形体 |
| B、它们都属于烃的衍生物 |
| C、五种氰基互为同系物 |
| D、HC11N属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
A、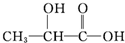 |
| B、HOOC-COOH |
| C、HOCH2CH2OH |
| D、CH3COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com