
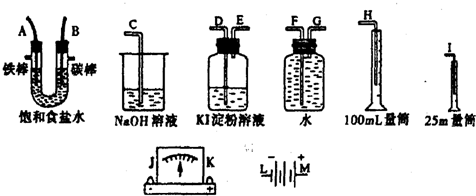
分析 (1)电源负极接电解池的铁棒、碳棒接电流计“-”端,“+”端接电源正极;
(2)要用铁棒和碳棒作电解电解氯化钠溶液制取氢气,则铁作阴极,碳棒作正极,阴极上氢离子放电生成氢气,阳极上氯离子放电生成氯气,氯气能使湿润的淀粉-KI试纸变蓝色;
(3)用碘化钾溶液检验氯气的氧化性,用氢氧化钠溶液处理氯气的尾气;用排水法收集氢气,用25mL量筒盛放排出的水,注意导气管遵循“长进短出”原则;
(4)(5)根据氢气和氢氧化钠的关系是计算氢氧化钠的物质的量,再根据c=$\frac{n}{V}$计算氢氧化钠浓度,再结合离子积常数计算氢离子浓度,从而得出溶液的pH.
解答 解:(1)电源负极接电解池的铁棒、碳棒接电流计“-”端,“+”端接电源正极,所以其连接顺序是:L→J→K→A→B→M,
故答案为:A;B;
(2)要用铁棒和碳棒作电解电解氯化钠溶液制取氢气,则铁作阴极,碳棒作阳极,阴极铁上氢离子得电子发生还原反应,电极反应式为2H++2e-═H2↑,阳极碳棒上氯离子失电子发生氧化反应,电极反应式为2Cl--2e-═Cl2↑,氯气能使湿润的淀粉-KI试纸变蓝色,所以检验氯气的方法和现象:用湿润的淀粉-KI试纸放在B电极的管口,试纸变为蓝色;
故答案为:2Cl--2e-═Cl2↑;用湿润的淀粉-KI试纸放在B电极的管口,试纸变为蓝色;
(3)电解池左边A导管口产生H2,右边B导管口产生Cl2,以电解池为中心,相应装置的作用: ,所以测定产生的氢气的体积时A接G→F→H,
,所以测定产生的氢气的体积时A接G→F→H,
故答案为:G;F;H;
(4)根据2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑中氢氧化钠和氢气的关系式知,n(NaOH)=$\frac{0.0056L}{22.4L/mol}$×2=5.0×10-4 mol,
根据原子守恒得n(OH-)=5.0×10-4 mol,c(OH-)=$\frac{5.0×1{0}^{-4}}{0.05L}$=0.010 mol/L,c(H+)=$\frac{1{0}^{-14}}{0.01}$=10-12 mol/L,pH=-lg10-12=12,
故答案为:12.
点评 本题以电解原理为载体考查了气体的制取、性质的检验等知识点,根据电解原理、物质的性质、物质间的关系等来分析解答即可,难点是仪器连接顺序,根据气体制取装置→检验装置→收集装置→尾气处理装置来排序即可,难度中等.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
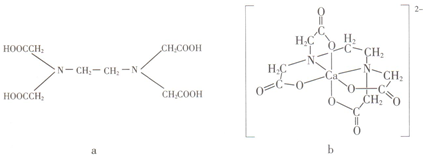
| A. | a和b中的N原子均为sp3杂化 | B. | b中Ca2+的配位数为4 | ||
| C. | b含有分子内氢键 | D. | b含有共价键、离子键和配位键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铜片消耗完所需时间 | B. | 反应生成的气体体积(标准状况下) | ||
| C. | 反应中氧化剂得到的电子总数 | D. | 反应后溶液中硝酸银离子的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,pH>7的醋酸和醋酸钠的混合溶液中:c(CH3COO-)>c(Na+) | |
| B. | 将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)=c(Cl-) | |
| C. | 等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH${\;}_{4}^{+}$)=c(K+)=c(Ba2+) | |
| D. | 0.2mol•L-1某一元弱酸HA溶液和0.1mol•L-1NaOH溶液等体积混合后的溶液:2c(OH-)+c(A-)=2c(H+)+c(HA) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com