
分析 (1)依据给出反应可知,二价铁离子被氧化为三价铁离子,1mol二价铁离子参加反应失去1mol电子,高锰酸根离子被还原为二价锰离子,1mol高锰酸根离子参加反应得到5mol电子,依据得失电子守恒结合原子个数守恒规律书写方程式;
(2)①氧化还原反应中氧化剂得到电子总数等于还原剂失去电子总数,为使得失电子总数相对,氧化反应整体5,还原反应整体乘以2,相加即可得到总反应方程式;
依据氧化反应:H2O2-2e-═2H++O2↑计算若有0.5 mol H2O2参加此反应,转移电子的个数;
②依据双氧水分解生成水和氧气,考虑二价锰离子在反应中起到催化剂作用.
解答 解:(1)依据给出反应可知,二价铁离子被氧化为三价铁离子,1mol二价铁离子参加反应失去1mol电子,高锰酸根离子被还原为二价锰离子,1mol高锰酸根离子参加反应得到5mol电子,依据得失电子守恒,二价铁离子系数为,5,高锰酸根离子系数为1,三价铁离子系数为5,二价锰离子系数为1,结合原子个数守恒,反应方程式:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
故答案为:5、1、8H+、5、1、4;
(2)①氧化还原反应中氧化剂得到电子总数等于还原剂失去电子总数,为使得失电子总数相对,氧化反应整体5,还原反应整体乘以2,相加即可得到总反应离子方程式:2MnO4+8H++5H2O2═5O2↑+2Mn2++8H2O,对应化学方程式为:5H2O2+2KMnO4+3H2SO4═2MnSO4+5O2↑+K2SO4+8H2O;
依据氧化反应:H2O2-2e-═2H++O2↑
1 2
0.5mol 1mol
所以反应中若有0.5 mol H2O2参加此反应,转移电子的个数为:NA;
故答案为:5H2O2+2KMnO4+3H2SO4═2MnSO4+5O2↑+K2SO4+8H2O;NA;
②实验中发现,当加入的少量KMnO4完全反应后,H2O2仍能发生反应快速放出气体,可能原因:还原产物Mn2+催化H2O2分解生成氧气;
故答案为:还原产物Mn2+催化H2O2分解生成氧气.
点评 本题考查了氧化还原反应,涉及氧化还原反应方程式配平,电子转移数目计算,明确氧化还原反应得失电子守恒规律是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 化合物2在一定条件下可发生加聚反应 | |
| B. | 检验制得的香草醛中是否混有化合物3,可用氯化铁溶液 | |
| C. | 理论上反应1→2中原子利用率100% | |
| D. | 化合物2→3的反应为消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液 | B. | 饱和NaHCO3溶液 | C. | NaOH溶液 | D. | Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


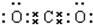


 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na +、SO42-、SO32- | B. | NH4+、Mg 2+、SO42-、Cl - | ||
| C. | Na +、K +、HCO3-、Cl - | D. | K +、Na +、NO3-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组的同学为制取少量溴乙烷,查阅资料得知:
某化学兴趣小组的同学为制取少量溴乙烷,查阅资料得知:| 乙醇 | 溴乙烷 | |
| 状态 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.8 | 1.4 |
| 沸点/℃ | 78.5 | 119.0 |
| 熔点/℃ | -130 | 38.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com