
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | e | f | h | |||||
| 3 | a | c | d | g | i | j | r | |
| 4 | b |
分析 由元素在周期表中位置,可知a为Na、b为K、c为Mg、d为Al、e为C、f为N,g为P,h为O,i为S,j为Cl,r为Ar.
(1)d元素的最高价为+3价;
(2)a为Na元素;
(3)e为C元素;
(4)同周期自左向右元素金属性减弱;
(5)非金属性越强,氢化物越稳定;
(6)c元素和j元素形成化合物为氯化镁;
(7)反应生成HCl;
(8)K与水反应生成KOH和氢气;
(9)f元素和g元素的原子序数分别为7、15.
解答 解:由元素在周期表中位置,可知a为Na、b为K、c为Mg、d为Al、e为C、f为N,g为P,h为O,i为S,j为Cl,r为Ar.
(1)d元素的最高价为+3价,则d元素的最高价氧化物是Al2O3,故答案为:Al2O3;
(2)a元素位于第三周期第IA族,它的元素符号是Na,故答案为:Na;
(3)e为C元素,最外层电子数为4,故答案为:4;
(4)a、b、c金属性为K>Na>Mg,则三种元素的最高价氧化物对应水化物中碱性最弱的是Mg(OH)2,故答案为:Mg(OH)2;
(5)非金属性O>S,稳定性为H2h>H2i,故答案为:>;
(6)c元素和j元素形成化合物为氯化镁,化学式为MgCl2,故答案为:MgCl2;
(7)反应生成HCl,反应为Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl,故答案为:Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl;
(8)K与水反应生成KOH和氢气,离子反应为2K+2H2O=2OH-+2K++H2↑,故答案为:2K+2H2O=2OH-+2K++H2↑;
(9)f元素和g元素的原子序数分别为7、15,两者核电荷数之差是15-7=8,故答案为:8.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意化学用语的使用,题目难度不大.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
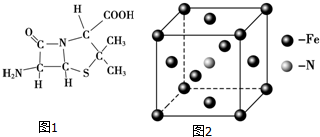
 )分子中有5n个σ键
)分子中有5n个σ键| 化学键 | Si-Si | O═O | Si-O |
| 键能(kJ•mol-1) | a | b | c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 54g H218O中含有电子总数为30NA个 | |
| B. | 11.2L H2中含有的电子数为NA个 | |
| C. | 23gNa+含有的最外层电子数为NA个 | |
| D. | 16g氧气和16g臭氧含有的核外电子总数均为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 断开一个N≡N,同时有六个N-H键生成 | |
| B. | 生成氨的速率与分解氨的速率相等 | |
| C. | N2、H2,、NH3的质量分数不再变化 | |
| D. | 混合气体总压不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
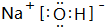 ,该化合物中所含的化学键有离子键、共价键.
,该化合物中所含的化学键有离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
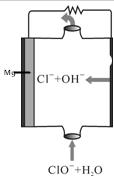
| A. | 电子由负极经电解质溶液移向正极 | |
| B. | ClO-参与的一极为正极 | |
| C. | 电池中镁为负极,发生氧化反应 | |
| D. | 放电过程中,溶液中Cl-的物质的量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com