


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
| A、②③ | B、③④ | C、①③ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O,对环境不会有影响 |
| B、侯氏制碱法是将NH3和CO2先后通入饱和氯化钠溶液中直接得到碳酸钠晶体 |
| C、我国自行研制的“神十”航天服是由新型“连续纤维增韧”材料做成的,其主要成分是由碳化硅陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 |
| D、PM2.5是指大气中直径≤2.5×10-6m的颗粒物(气溶胶),可通过加水吸收后再利用过滤的方法分离PM2.5微粒和可溶性吸附物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
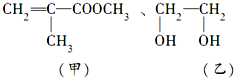
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| n(SO32-):n(HSO3-) | 99:1 | 1:1 | 1:99 |
| pH | 8.2 | 7.2 | 6.2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制作航天服的聚酯纤维和用于通讯光缆的光导纤维都是新型无机非金属材料 |
| B、不锈钢餐具和温度计中的水银都属于合金 |
| C、福岛核电站泄漏的放射性物质131I和127I互为同素异形体,化学性质几乎相同 |
| D、绿色化学的核心是利用化学原理从源头上减少和消除化学工业生产对环境的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将等物质的量浓度、等体积的Ba(OH)2溶液和NaHS04溶液混合,生成白色沉淀:Ba2++SO42?+H++OH?═BaSO4↓+H2O | ||
| B、常温下,等物质的量浓度的三种溶液①(NH4)2CO3 ②NH4Cl ③(NH4)2Fe(SO4)2中c(NH4+):①<②<③ | ||
| C、加入苯酚显紫色的溶液中:K+、NH4+、Cl-、I-四种离子不能大量共存 | ||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com