
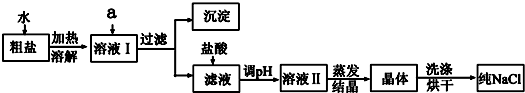
分析 实验流程为:粗盐样品含有Na2SO4、MgCl2、CaCl2等杂质,加入过量的氯化钡,可以将硫酸根离子除去,但是会引入钡离子杂质离子,加入过量氢氧化钠溶液的目的是除去氯化镁,加入过量的碳酸钠溶液的目的除去杂质CaCl2和加入的过量试剂BaCl2,过滤,将得到的沉淀全部滤出,得到的滤液是含有氯化钠、碳酸钠、氢氧化钠等的混合物,加入足量的盐酸,可以出去碳酸根离子、氢氧根离子等杂质离子,最后即可获得较为纯净的氯化钠,
(1)加入氯化钡除去硫酸根离子,加入氢氧化钠除去镁离子,加入试剂A的是为了除去钙离子及过量的钡离子,则试剂A为碳酸钠溶液;
(2)Ca2+、Mg2+、SO42-离子分别转化成CaCO3、Mg (OH)2、BaSO4,过量钡离子转化成了BaCO3,据此分析滤渣的组成;
(3)盐酸的作用是除掉过量的CO32-、OH-;
(4)根据配制一定物质的量浓度溶液的步骤分析需要仪器;
(5)若BaCl2已过量,则再加入氯化钡不会生成沉淀,据此判断检验方法;
(6)CaCO3、BaCO3、Mg(OH)2沉淀可以溶解在盐酸中,生成一部分杂质,除杂效果不好.
解答 解:实验流程为:粗盐样品含有Na2SO4、MgCl2、CaCl2等杂质,加入过量的氯化钡,可以将硫酸根离子除去,但是会引入钡离子杂质离子,加入过量氢氧化钠溶液的目的是除去氯化镁,加入过量的碳酸钠溶液的目的除去杂质CaCl2和加入的过量试剂BaCl2,过滤,将得到的沉淀全部滤出,得到的滤液是含有氯化钠、碳酸钠、氢氧化钠等的混合物,加入足量的盐酸,可以出去碳酸根离子、氢氧根离子等杂质离子,最后即可获得较为纯净的氯化钠,
(1)粗盐中含有少量Ca2+、Mg2+、SO42-,加入过量的氯化钡溶液可除去SO42-,加入NaOH溶液除去Mg2+,此时溶液中含有杂质为Ca2+、Ba2+,需要加入过量的Na2CO3除去,
故答案为:Na2CO3;
(2)步骤⑤是将生成的沉淀通过过滤分离,由于Ca2+、Mg2+、SO42-离子分别转化成CaCO3、Mg (OH)2、BaSO4,过量钡离子转化成了BaCO3,则滤渣中含有的物质有BaSO4、CaCO3、Mg (OH)2、BaCO3,
故答案为:BaSO4;CaCO3;Mg (OH)2;
(3)盐酸的作用是除掉过量的CO32-、OH-,发生的化学反应为:Na2CO3+2HCl=2NaCl+CO2↑+H2O、NaOH+HCl=H2O+NaCl,
故答案为:Na2CO3+2HCl═2NaCl+CO2↑+H2O;NaOH+HCl═NaCl+H2O;
(4)用提纯的NaCl固体配制480mL 1.0mol/L的NaCl溶液,需要选用500mL容量瓶,实际上配制的是500mL 1.0mol/L的溶液,配制步骤为:计算、称量、溶解、转移、洗涤、定容、摇匀等,需要的仪器有:烧杯、玻璃棒、胶头滴管、药匙、500mL容量瓶、托盘天平,还需要的仪器为:500mL容量瓶、托盘天平,
故答案为:500mL容量瓶、托盘天平;
(5)BaCl2已过量,则再加入氯化钡不会生成沉淀,则实验方法为用试管取少量取少量上层清液于试管中,再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量,
故答案为:再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量;
(6)由于盐酸能够与碳酸钡、碳酸钙、氢氧化镁发生反应,先用盐酸调pH再过滤,导致少量CaCO3、BaCO3、Mg(OH)2沉淀溶解,使NaCl混有杂质,
故答案为:会将沉淀溶解,重新引入杂质.
点评 本题考查了物质分离与提纯方法的综合应用,题目难度中等,明确实验原理、实验目的为解答关键,注意掌握常见物质分离与提纯方法,试题充分考查了学生的分析、理解能力及化学实验能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | KCl固体混有KClO3:加少量二氧化锰固体并加热 | |
| B. | CO2中混有CO气体:通入氧气中点燃 | |
| C. | 硝酸钾溶液中混有氯化钠:加入四氯化碳萃取并分液 | |
| D. | Cu(NO3)2溶液混有AgNO3:加入过量的铜粉并过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙中加入盐酸:CO32-+2H+═H2O+CO2↑ | |
| B. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 碳酸钠溶液中加入氢氧化铜:Cu2++CO32-═CuCO3↓ | |
| D. | 澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3作耐火材料是因为氧化铝熔点高 | |
| B. | 光导纤维具有很强的导电能力,应用于制造通信光缆 | |
| C. | 过氧化钠用于呼吸面具中是因为过氧化钠是强氧化剂能氧化CO2和水 | |
| D. | FeCl3溶液可用于铜质印刷线路板制作是因为FeCl3能与铜单质发生置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)良好的生态环境可以提升生活质量.
(1)良好的生态环境可以提升生活质量.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com