
| A. | C的质最不再改变 | |
| B. | 物质的最浓度c(A):c(B):c(C):c(D)=m:n:p:q | |
| C. | 各组分浓度不再改变 | |
| D. | 单位时间内m molA断键,同时pmolC也断键 |
分析 可逆反应达到平衡状态时,正逆反应速率相等,反应体现中各物质的物质的量不变、物质的量浓度不变以及由此引起的一系列物理量不变,据此分析解答.
解答 解:A.C的质量不再改变,说明正逆反应速率相等,所以该反应达到平衡状态,故A不选;
B.物质的最浓度c(A):c(B):c(C):c(D)=m:n:p:q的状态,并不是不变的状态,故B选;
C.各组分浓度不再改变,说明各物质的量不变,反应达平衡状态,故C不选;
D.单位时间内m mol A断键发生反应,同时p mol C也断键发生反应,正逆反应速率相等,该反应达到平衡状态,故D不选;
故选B.
点评 本题考查化学平衡状态的判断,只有反应前后改变的物理量才能作为化学平衡状态的判断依据,要注意结合反应方程式特点分析,题目难度中等.


科目:高中化学 来源: 题型:解答题
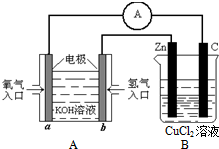 到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:H2SO4>HClO4 | B. | 碱性:NaOH>KOH | ||
| C. | 非金属性:P>S>Cl | D. | 气态氢化物稳定性:HF>HCl>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
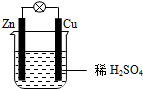
| A. | Cu为负极,Zn为正极 | B. | 电子从铜片经外电路流向锌片 | ||
| C. | 负极反应为:Zn-2e-═Zn2+ | D. | 该装置将电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氯乙烷制备乙醇 | B. | 石油裂解制丙烯 | ||
| C. | 乙醇与乙酸反应制乙酸乙酯 | D. | 油脂与浓NaOH反应制高级脂肪酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
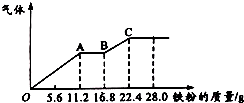 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A. | 混合酸中H2SO4浓度为4 mol•L-1 | |
| B. | 200mL混合酸中NO3-物质的量为0.2mol | |
| C. | AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 | |
| D. | 加入铜粉的那份混合酸,反应后剩余0.1mol H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂水解可生成高级脂肪酸和丙三醇 | |
| B. | 淀粉水解的最终产物能与新制的Cu(OH)2悬浊液反应 | |
| C. | 淀粉和纤维素的分子式均可用(C6H10O5)n表示,他们互为同分异构体 | |
| D. | 蛋白质溶液中加入饱和硫酸铵溶液后产生的沉淀能重新溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
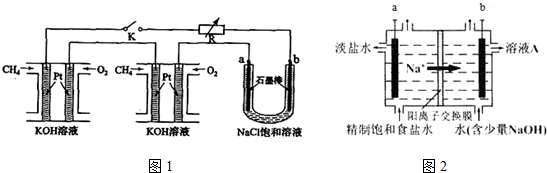
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com