
【题目】Cl2 和 H2O2 是常见的两种氧化剂,经查阅资料 Cl2 氧化能力强于 H2O2,能将 H2O2 氧化。 为了验证该结论,学生设计了如下图所示的实验装置进行实验(夹持装置略去)。圆底烧瓶 A 中的反应方程式为 2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8 H2O,请回答:
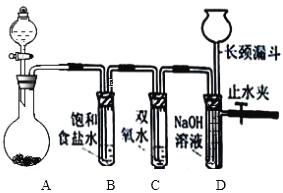
(1)试管 B 中饱和食盐水的作用是________________________;
(2)试管 C 中加入 5mL 30% 双氧水,发生反应的化学方程式_________________________;
(3)试管 D 中充满 10% NaOH 溶液,NaOH 溶液的作用是________________________;
(4)将浓盐酸注入圆底烧瓶 A,当装置中的空气基本排尽后关闭止水夹,反应一段时间后试管 D中的现象为________________________,试管 D 中的气体检验方法为_______________ 。
【答案】(1)除去Cl2中混有的HCl; (2)Cl2+H2O2=2HCl+O2; (3)吸收多余的Cl2;
(4)试管D中液面下降,长颈漏斗中液面上升;该气体能使带火星的木条复燃,证明是氧气;
【解析】
试题(1)该实该验采用高锰酸钾固体和浓盐酸的方法制取氯气,产生的氯气中容易混有氯化氢气体,要除去氯化氢气体,所选的除杂试剂只能吸收氯化氢而不能吸收氯气,故可以使用饱和食盐水将其除去;
(2)Cl2氧化能力强于H2O2,试管C中氯气氧化过氧化氢生成氧气,自身被还原成氯化氢,反应为:Cl2+H2O2=2HCl+O2;
(3)氯气是一种有剧烈刺激性气味、有毒的气体,须进行尾气处理,试管D中充满10% NaOH溶液,氯气跟NaOH溶液反应Cl2+2NaOH=NaCl+NaClO+H2O,吸收多余的Cl2;
(4)Cl2+H2O2=2HCl+O2,当关闭止水夹,反应一段时间后试管D中因氧气不断增多,气体压强增大,所以试管D中液面下降,长颈漏斗中液面上升,氧气使带火星的木条复燃,可用此法验证氧气。


科目:高中化学 来源: 题型:
【题目】拟用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。下列可以得到干燥纯净的气体的选项是( )

选项 | 气体 | a | b | c | d |
A | CO2 | 盐酸 | CaCO3 | 饱和Na2CO3溶液 | 浓硫酸 |
B | NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 固体NaOH |
C | Cl2 | 浓盐酸 | MnO2 | 饱和NaCl溶液 | 浓硫酸 |
D | NO2 | 浓硝酸 | 铜屑 | H2O | 固体NaOH |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:_____H2O2 +___Cr2(SO4)3 +_______KOH=________K2CrO4 +________K2SO4 +_______H2O
(1)配平该方程式,并用单线桥法表示电子转移情况。
(2)此反应中氧化剂是__________。
(3)若消耗1molL-1Cr2(SO4)3溶液的体积为50mL,则转移电子的物质的量是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是( )

A. X、Y、Z三种元素最低价氢化物的沸点依次升高
B. 由X、Y和氢三种元素形成的化合物中只有共价键
C. 物质WY2、W3X4、WZ4均有熔点高、硬度大的特性
D. T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质与反应的分类正确的是
A.纯碱、醋酸钠分别属于碱和盐
B.Na、Na2O2与水的反应均是置换反应
C.氯水和次氯酸都属于弱电解质
D.铝与强酸、强碱的反应都属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
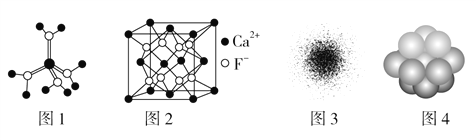
A. 水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键
B. CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+
C. H原子的电子云图如图3所示,H原子核外大多数电子在原子核附近运动
D. 金属铜中Cu原子堆积模型如图4为最密堆积每个Cu原子的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组设定以下实验方案,测定某已变质为碳酸钠的小苏打样品中NaHCO3的质量分数。
方案一:称取一定质量样品,置于坩埚中加热至恒重,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:__________________;
(2)实验中需加热至恒重的目的是:___________________;
方案二:称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为_____________;
(2)实验中判断沉淀是否完全的方法是_______________________。
方案三:按如图装置进行实验:
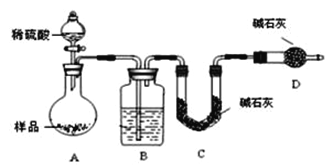
(1)B装置内所盛试剂是_________;D装置的作用是_______;分液漏斗中_______(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.9g样品,实验后测得C装置增重8.8g,则样品中NaHCO3的质量分数为____。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com