
以下有关元素性质的说法不正确的是( )
A.具有下列电子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4,原子半径最大的是①
B.下列原子的价电子排布中,①3s23p1 ②3s23p2 ③3s23p3 ④3s23p4,对应的第一电离能最大的是③
C.某元素的逐级电离能(kJ/mol)分别为738、1451、7733、10540、13630、17995、
21703,当它与氯气反应时最可能生成的阳离子是X3+
D. ①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数的增加而递增的是④
科目:高中化学 来源: 题型:
下列各组物质,不能按右图(“→”表示反应一步完成)关系转化的是
| 选项 | a | b | c |
| A | S | SO3 |
|
| B | SiO2 | Na2SiO3 | H2SiO3 |
| C | AlCl3 | NaAlO2 | Al(OH)3 |
| D | Cu | CuO | Cu(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学对FeCl3的氧化性以及FeSO4的热稳定性进行如下探究:
(1)查阅资料FeSO4高温分解,反应方程式为: 2FeSO4 Fe2O3+SO2↑+SO3↑。
Fe2O3+SO2↑+SO3↑。
①用双线桥标出高温分解FeSO4制备Fe2O3反应中电子转移的方向和数目 ▲ 。
②为收集SO3并验证SO2,应将气体依次通过浸没在 ▲ 中的U型管、洗气瓶中的 ▲ 和NaOH溶液。
(2)实验探究Fe3+的氧化性:向FeCl3溶液中通入一定量的SO2气体,溶液由黄色变为浅绿色。
①浅绿色溶液中一定存在的离子有H+、Cl-和 ▲ ,可能存在的微粒有 ▲ (填写序号)。
A.Fe3+ B.Fe2+ C.SO42- D.H2SO3
②为确认可能存在的微粒,应选择的试剂是 ▲ (填写序号)。
A.稀硫酸 B.NaOH溶液 C.KSCN溶液 D.品红溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.在气体单质分子中,一定含有σ键,可能含有π键
B.烯烃比烷烃的化学性质活泼是由于烷烃中只含σ键而烯烃含有π键
C.等电子体结构相似,化学性质相同
D.共价键的方向性决定了原子在形成分子时相互结合的数量关系
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中不正确的是( )
A.氯化钠的晶体结构为非等径圆球密堆积
B.晶体尽量采取紧密堆积方式以使其变得比较稳定
C.因为共价键有饱和性和方向性,所以原子晶体不遵循“紧密堆积”原则
D.金属铜和镁均以ABAB方式密堆积
查看答案和解析>>
科目:高中化学 来源: 题型:
下列操作方法或实验装置正确的是( )
① 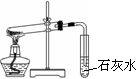
 ②
② 
 ③
③ 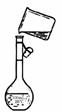 ④
④ 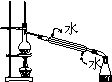

A.装置①探究NaHCO3的热稳定性
B.装置②Cl2的收集
C.装置③向容量瓶中转移液体
D.装置④石油蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.从苯的分子组成来看远没有达到饱和,所以能使溴水褪色
B.苯能使酸性高锰酸钾溶液褪色
C.苯的一氯取代物只有一种
D.苯是单、双键交替组成的环状结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com