
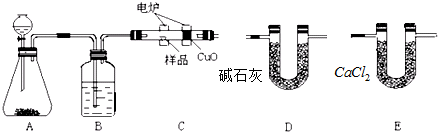
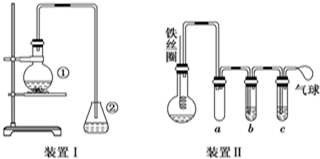
分析 实验原理是测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,求出最简式.因此生成O2后必须除杂(主要是除H2O)明确各装置的作用是解题的前提,A用来制取反应所需的氧气、B用来吸收水、C是在电炉加热时用纯氧气氧化管内样品、D用来吸收产生的二氧化碳、E是吸收水;根据一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2;确定物质的化学式可借助元素的质量守恒进行解答,
(1)双氧水可分解生成氧气,需要二氧化锰作催化剂;
(2)因反应原理是纯氧和有机物反应,故B的作用是除去氧气中的水蒸气,CuO的作用是使有机物不完全燃烧生成的CO充分氧化生成CO2;
(3)D装置中碱石灰能把水和二氧化碳全部吸收,而E装置中氯化钙只吸收水分,为了称取产物水和二氧化碳的质量,故应先吸收水再吸收二氧化碳,据此作用排序;
(4)D管质量增加2.64g克说明生成了2.64g二氧化碳,E管质量增加1.08g,说明生成了1.08g的水,计算出碳氢质量,根据质量守恒计算氧质量,算出碳氢氧个数比,写出实验式,根据相对密度计算相对分子质量,求出分子式,根据性质结合分子式写出可能结构.
解答 解:(1)双氧水可分解生成氧气,A装置中分液漏斗盛放的物质是双氧水,化学方程式为2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,
故答案为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑;
(2)因反应原理是纯氧和有机物反应,故B的作用是除去氧气中的水蒸气,CuO的作用是使有机物不完全燃烧生成的CO充分氧化生成CO2,
故答案为:吸收氧气中的水蒸气;可将产生的CO氧化成CO2;
(3)D装置中碱石灰能把水和二氧化碳全部吸收,而E装置中氯化钙只吸收水分,为了称取产物水和二氧化碳的质量,故应先吸收水再吸收二氧化碳,故燃烧管C与装置D、E的连接顺序是:C→E→D,故答案为:E;D;
(4)D管质量增加2.64g克说明生成了2.64g,n(CO2)=$\frac{2.64g}{44g/mol}$=0.06mol,m(C)=0.06mol×12g/mol=0.72g;
E管质量增加1.08g,说明生成了1.08g的水,n(H2O)=$\frac{1.08g}{44g/mol}$=0.06mol,m(H)=0.06mol×2×1g/mol=0.12g;
从而可推出含氧元素的质量为:1.8g-0.72g-0.12g=0.96g,n(O)=$\frac{0.96g}{16g/mol}$=0.06mol,
N(C):N(H):N(O)=0.06mol:0.12mol:0.06mol=1:2:1,
故该有机物的实验式为CH2O,式量为30,
该有机物的相对分子质量为:45×2=90,设分子式为 CnH2nOn,30n=90,解得n=3,故分子式为:C3H6O3;
因 1molX分别与足量Na、NaHCO3反应放出的气体在相同条件下的体积比为1:1,则含一个羟基和一个羧基,
故该有机物结构简式为:CH3CH(OH)-COOH、HO-CH2CH2-COOH;
故答案为:C3H6O3;CH3CH(OH)-COOH、HO-CH2CH2-COOH.
点评 本题考查有机物的分子式的实验测定,题目难度中等,注意实验的原理是解题关键,侧重考查学生运用所学化学知识综合分析和解决实际问题的能力,强调了学生整合知识的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
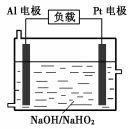 已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在.目前研究比较热门的Al-H2O2燃料电池,其原理如图所示,电池总反应如下:
已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在.目前研究比较热门的Al-H2O2燃料电池,其原理如图所示,电池总反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (不考虑空间构型,如有配位键,请标出)
(不考虑空间构型,如有配位键,请标出)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X中肯定有碳碳双键 | |
| B. | X中可能有三个羟基和一个 一COOR官能团 | |
| C. | X中可能有三个羧基 | |
| D. | X中可能有两个羧基和一个羟基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 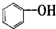 属于醇类化合物 属于醇类化合物 | B. | 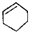 属于芳香族化合物 属于芳香族化合物 | ||
| C. |  属于脂环化合物 属于脂环化合物 | D. | CH3CH(CH3)2属于链状化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol O2作为氧化剂得到的电子数为2NA | |
| B. | 在0℃,101kPa时,22.4 L氢气中含有NA个氢原子 | |
| C. | NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 | |
| D. | 25℃,1.01×105Pa,64gSO2中含有的原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
. 与Br2,要想得到纯净的产物,可用NaOH溶液(或水)试剂洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗.
与Br2,要想得到纯净的产物,可用NaOH溶液(或水)试剂洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com