
ŅŃÖŖ£ŗN2(g)+3H2(g) 2NH3(g)”÷H=" ”Ŗ92" kJ/mol£¬Ļą¹ŲŹż¾ŻČēĻĀ±ķ”£Ņ»¶ØĢõ¼žĻĀ£¬ŌŚĢå»żĪŖ1LµÄĆܱÕČŻĘ÷ÖŠ¼ÓČė1molN2ŗĶ3molH2³ä·Ö·“Ó¦£¬·Å³öČČĮæQ1kJ£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
2NH3(g)”÷H=" ”Ŗ92" kJ/mol£¬Ļą¹ŲŹż¾ŻČēĻĀ±ķ”£Ņ»¶ØĢõ¼žĻĀ£¬ŌŚĢå»żĪŖ1LµÄĆܱÕČŻĘ÷ÖŠ¼ÓČė1molN2ŗĶ3molH2³ä·Ö·“Ó¦£¬·Å³öČČĮæQ1kJ£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
| | H2(g) | N2(g) | NH3(g) |
| 1mol·Ö×ÓÖŠµÄ»Æѧ¼üŠĪ³ÉŹ±ŅŖŹĶ·Å³öµÄÄÜĮæ/kJ | 436 | 946 | a |
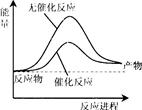
D
½āĪöŹŌĢā·ÖĪö£ŗA£®ÓŅĶ¼±ķŹ¾ŗĻ³É°±¹ż³ĢÖŠŌŚÓŠ”¢ĪŽ“߻ƼĮŹ±µÄ·“Ó¦Ķ¾¾¶µÄ±ä»Æ£¬“ķĪó”£B,aµÄŹżÖµĒó½āĪŖ£ŗ 2a +£Ø946+3”Į436£©=92£¬½āµĆa=1173£¬“ķĪó”£C”£øĆ·“Ó¦ŹĒæÉÄę·“Ó¦£¬²»ÄܽųŠŠµ½µ×£¬¹Ź·Å³öČČĮæŠ”ÓŚ92£¬“ķĪó”£D,Ōö“ó·“Ó¦ĪļÅضČĘ½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬·Å³öČČĮæ“óÓŚŌĄ“µÄ2±¶”£ÕżČ·”£
æ¼µć£ŗ漲鷓ӦĶ¾¾¶”¢·“Ó¦ČČæÉÄę·“Ó¦”¢Ķā½ēĢõ¼ž¶Ō»ÆŃ§Ę½ŗāµÄÓ°ĻģµČÖŖŹ¶”£


 דŌŖ·»Č«³ĢĶ»Ęʵ¼Į·²āĻµĮŠ“š°ø
דŌŖ·»Č«³ĢĶ»Ęʵ¼Į·²āĻµĮŠ“š°ø Ö±ĶعóÖŻĆūŠ£ÖܲāŌĀæ¼Ö±ĶØĆūŠ£ĻµĮŠ“š°ø
Ö±ĶعóÖŻĆūŠ£ÖܲāŌĀæ¼Ö±ĶØĆūŠ£ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ŗĻĄķĄūÓĆČ¼ĮĻ¼õŠ”ĪŪČ¾·ūŗĻ”°ĀĢÉ«°ĀŌĖ”±ĄķÄī£¬ĻĀĮŠ¹ŲÓŚČ¼ĮĻµÄĖµ·ØÕżČ·µÄŹĒ( )
| A£®”°æÉČ¼±ł”±ŹĒ½«Ė®±äĪŖÓĶµÄŠĀŠĶČ¼ĮĻ |
| B£®ĒāĘųŹĒ¾ßÓŠČČÖµøß”¢ĪŽĪŪČ¾µČÓŵćµÄČ¼ĮĻ |
| C£®ŅŅ“¼ŹĒ±ČĘūÓĶøü»·±£”¢²»æÉŌŁÉśµÄČ¼ĮĻ |
| D£®ŹÆÓĶŗĶĆŗŹĒ¹¤³§¾³£Ź¹ÓƵÄæÉŌŁÉśµÄ»ÆŹÆČ¼ĮĻ] |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
¾Ż±ØµĄ£¬æĘѧ¼ŅæŖ·¢³öĮĖĄūÓĆĢ«ŃōÄÜ·Ö½āĖ®µÄŠĀŠĶ“߻ƼĮ”£ĻĀĮŠÓŠ¹ŲĖ®·Ö½ā¹ż³ĢµÄÄÜĮæ±ä»ÆŹ¾ŅāĶ¼ÕżČ·µÄŹĒ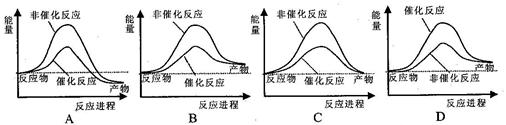
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
Ė®ŹĒÉśĆüÖ®Ō“£¬Ņ²ŹĒ»Æѧ·“Ó¦ÖŠµÄÖ÷½Ē”£Ēė»Ų“šĻĀĮŠĪŹĢā:
¢ń”¢ĒāĘųČ¼ÉÕÉś³ÉŅŗĢ¬Ė®ČČ»Æѧ·½³ĢŹ½ŹĒ2H2(g)+O2(g)=2H2O(l) ¦¤H=£572kJ/mol”£
(1)Éś³ÉĪļÄÜĮæ×ÜŗĶ(Ģī”°“óÓŚ”±”¢”°Š”ÓŚ”±»ņ”°µČÓŚ”±)·“Ó¦ĪļÄÜĮæ×ÜŗĶ”£
(2)Čō2 molĒāĘųĶźČ«Č¼ÉÕÉś³ÉĖ®ÕōĘų£¬Ōņ·Å³öµÄČČĮæ 572 kJ(Ģī”°£¾”±”¢”°£¼”±»ņ”°£½”±)”£
(3)ĒāĘųČČÖµĪŖ ”£
¢ņ”¢ĒāĘųŗĶŃõĘų·“Ӧɜ³ÉĖ®£¬½«»ÆѧÄÜ×Ŗ»ÆĪŖµēÄÜ£¬Ęä¹¹ŌģČēĶ¼ĖłŹ¾£ŗa”¢bĮ½øöµē¼«¾łÓɶąæ×µÄĢ¼æé×é³É”£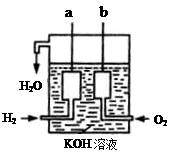
(1)aµē¼«·“Ó¦Ź½ŹĒ
(2)bµē¼«·“Ó¦Ź½ŹĒ
¢ó”¢ČēĶ¼±ķŹ¾Ņ»øöµē½ā³Ų”£X”¢Y¶¼ŹĒ¶čŠŌµē¼«£¬µē½āŅŗaŹĒ±„ŗĶŹ³ŃĪĖ®£¬Ķ¬Ź±ŌŚĮ½±ßø÷µĪČė¼øµĪ·ÓĢŖŹŌŅŗ”£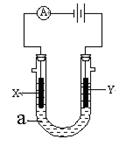
(1£©X¼«ÉĻµÄµē¼«·“Ó¦Ź½ĪŖ £¬
ŌŚX¼«ø½½ü¹Ū²ģµ½µÄĻÖĻóŹĒ ”£
(2)Y¼«ÉĻµÄµē¼«·“Ó¦Ź½ĪŖ £¬
¼ģŃéøƵē¼«·“Ó¦²śĪļµÄ·½·ØŹĒ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ĶźČ«Č¼ÉÕŅ»¶ØÖŹĮæµÄĪŽĖ®ŅŅ“¼£¬·Å³öµÄČČĮæĪŖQ£¬ĪŖĶźČ«ĪüŹÕÉś³ÉµÄCO2£¬²¢Ź¹Ö®Éś³ÉÕżŃĪNa2CO3£¬Ļūŗĵō0.8mol£ÆL NaOHČÜŅŗ500mL£¬ŌņČ¼ÉÕ1mol¾Ę¾«·Å³öµÄČČĮæŹĒ
| A£®0.2Q | B£®0.1Q | C£®5Q | D£®10Q |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
½«20g Ba£ØOH£©2”¤8H2O¾§ĢåÓė10 g NH4Cl¾§ĢåŅ»Ęš·ÅČėŠ”ÉÕ±ÖŠ£¬½«ÉÕ±·ÅŌŚµĪÓŠ3”«4µĪĖ®µÄ²£Į§Ę¬ÉĻ£¬ÓĆ²£Į§°ōŃøĖŁ½Į°č”£ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
| A£®ŹµŃéÖŠ²£Į§°ōµÄ×÷ÓĆŹĒ¼ÓĖŁ¹ĢĢåČܽā |
| B£®²£Į§Ę¬ÉĻ½į±ł¶ųÓėŠ”ÉÕ±Õ³ŌŚŅ»Ęš£¬ĖµĆ÷øĆ·“Ó¦ŹĒ·ÅČČ·“Ó¦ |
| C£®ĖłČ”·“Ó¦ĪļÖŹĮæµÄ¶ąÉŁ»įÓ°Ļģ·“Ó¦ŹĒĪüČČ£¬»¹ŹĒ·ÅČČ |
| D£®øĆ·“Ó¦ÖŠ£¬·“Ó¦ĪļµÄ×ÜÄÜĮæŠ”ÓŚÉś³ÉĪļµÄ×ÜÄÜĮæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ėĀ(N2H4)ŹĒ»š¼ż·¢¶Æ»śµÄŅ»ÖÖČ¼ĮĻ£¬·“Ó¦Ź±N2O4ĪŖŃõ»Æ¼Į£¬Éś³ÉN2ŗĶĖ®ÕōĘų”£ŅŃÖŖ£ŗ
N2(g)+2O2(g)=N2O4(g) ¦¤H="+8.7" kJ”¤mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ¦¤H="-534.0" kJ”¤mol-1
ĻĀĮŠ±ķŹ¾ėĀøśN2O4·“Ó¦µÄČČ»Æѧ·½³ĢŹ½£¬ÕżČ·µÄŹĒ
| A£®2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ¦¤H="-542.7" kJ”¤mol-1 |
| B£®2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ¦¤H="-1059.3" kJ”¤mol-1 |
C£®N2H4(g)+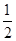 N2O4(g)= N2O4(g)=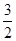 N2(g)+2H2O(g) ¦¤H="-1076.7" kJ”¤mol-1 N2(g)+2H2O(g) ¦¤H="-1076.7" kJ”¤mol-1 |
| D£®2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ¦¤H="-1076.7" kJ”¤mol-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ŅŃÖŖŌŚŅ»¶ØĢõ¼žĻĀ£¬COµÄČ¼ÉÕČČĪŖ283 kJ/mol£¬CH4µÄČ¼ÉÕČČĪŖ890 kJ/mol£¬ÓÉ1 mol COŗĶ3 mol CH4×é³É»ģŗĻĘųĢåŌŚÉĻŹöĢõ¼žĻĀ³ä·ÖČ¼ÉÕ£¬ŹĶ·ÅµÄČČĮæĪŖ
| A£®2912 kJ | B£®2953 kJ | C£®3236 kJ | D£®3867 kJ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ĻĀĮŠ¹ŲÓŚø÷Ķ¼µÄŠšŹöÖŠ£¬ÕżČ·µÄŹĒ
A£®Ķ¼¼×±ķŹ¾£±mol H2 (g)ĶźČ«Č¼ÉÕÉś³ÉĖ®ÕōĘųĪüŹÕ241.8 kJČČĮæ
B£®Ķ¼¼×±ķŹ¾2 mol H2(g)Ėł¾ßÓŠµÄÄÜĮæ±Č2 molH2O(g)Ėł¾ßÓŠµÄÄÜĮæ¶ą483.6 kJ
C£®Ķ¼ŅŅ±ķŹ¾³£ĪĀĻĀĻ”ŹĶHA”¢HBĮ½ÖÖĖįµÄĻ”ČÜŅŗŹ±£¬ČÜŅŗpHĖę¼ÓĖ®ĮæµÄ±ä»Æ£¬ŌņĶ¬ĪĀ”¢Ķ¬ÅØ¶ČµÄNaAČÜŅŗµÄpHŠ”ÓŚNaBČÜŅŗµÄpH
D£®Ķ¼ŅŅÖŠĘšŹ¼Ź±HAµÄĪļÖŹµÄĮæÅØ¶Č“óÓŚHB
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com