
| A. | 制皂 | B. | 造纸 | C. | 精炼石油 | D. | 制食盐 |
科目:高中化学 来源: 题型:选择题
| A. | 检验自来水中含有Cl- | B. | 检验鸡蛋壳中含有碳酸盐 | ||
| C. | 检验加碘食盐中加的不是碘单质 | D. | 除去热水瓶中的水垢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
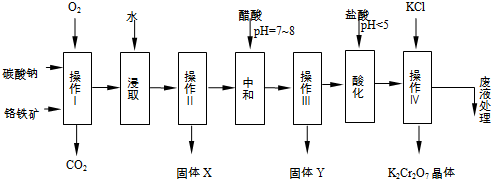
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水只含Cl2和H2O两种分子 | B. | 氢氟酸不能贮放在玻璃瓶里 | ||
| C. | 光导纤维的主要成分是二氧化硅 | D. | 浓硫酸用铁制容器密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀盐酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硝酸银溶液中加入铜粉 Ag++Cu═Cu2++Ag | |
| C. | 氧化铜与盐酸反应 O2-+2H+═H2O | |
| D. | 碳酸镁跟稀硫酸反应:MgCO3+2H+═Mg2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
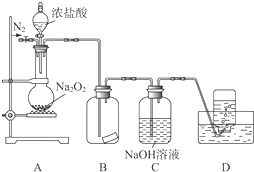 某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置.
某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com