
| A、Na+、K+、HCO3-、NO3- |
| B、Na+、K+、Cl-、MnO4- |
| C、NH4+、K+、SO42-、NO3- |
| D、Na+、Fe2+、NO3-、Cl- |


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
 A、B、C是与生命活动密切相关的三种常见化合物,每种物质所含元素种类均不超过三种,甲是单质.它们之间有如图所示的转化关系:
A、B、C是与生命活动密切相关的三种常见化合物,每种物质所含元素种类均不超过三种,甲是单质.它们之间有如图所示的转化关系:| 点燃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲、乙两池电极材料都是铁棒与碳棒,两池中均为饱和NaCl溶液.请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒,两池中均为饱和NaCl溶液.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol Na2O2固体中含离子总数为4NA |
| B、0.1mol铁粉与足量水蒸气反应生成的H2分子数为0.1NA |
| C、常温常压下,22.4L乙烯中C-H键数为4NA |
| D、等物质的量的干冰和葡萄糖中所含碳原子数之比为1:6,氧原子数之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解精炼铜时,阳极溶解的金属的质量与阴极析出的金属的质量不相等 |
| B、电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 |
| C、合成氨生产过程中增大N2的浓度可同时提高N2、H2的转化率 |
| D、硫酸工业中,使用催化剂是为了提高SO2转化为SO3的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2与H2O反应:Na2O2+H2O=2Na++2OH-+O2↑ |
| B、硫酸铝与过量氨水反应:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| C、NO2溶于水:3NO2+H2O=2H++2NO3-+NO |
| D、用FeCl3溶液腐蚀铜线路板:Cu+Fe3+=Cu2++Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
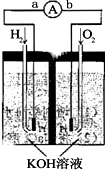 氢氧燃料电池是符合绿色化学理念的新型发电装置.
氢氧燃料电池是符合绿色化学理念的新型发电装置.
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com