
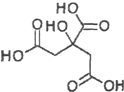
| A. | X分子式为C6H6O7 | |
| B. | X可发生水解反应、加成反应、氧化反应 | |
| C. | X分子内所有碳原子均在同一平面内 | |
| D. | 1mol物质X与足量的Na反应可产生2mol H2 |
分析 A.根据结构简式确定分子式;
B.该物质中含有羧基、醇羟基,具有羧酸和醇的性质;
C.该分子中含有亚甲基,应该具有甲烷结构特点;
D.羧基和醇羟基都能与Na反应生成氢气且含有3个羧基、1个醇羟基.
解答 解:A.X分子式为C6H8O7,故A错误;
B.该物质中含有羧基、醇羟基,具有羧酸和醇的性质,能发生氧化反应、酯化反应、缩聚反应,但不能发生缩聚反应和加成反应,故B错误;
C.该分子中含有亚甲基,应该具有甲烷结构特点,所以所有碳原子不可能共平面,故C错误;
D.羧基和醇羟基都能与Na反应生成氢气且含有3个羧基、1个醇羟基,1mol物质X与足量的Na反应可产生2mol H2,故D正确;
故选D.
点评 本题考查有机物结构和性质,为高频考点,把握结构中官能团与性质的关系为解答的关键,侧重醇、羧酸等有机物性质的考查,注意羧基中碳氧双键不能发生加成反应,为易错点.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液(BaCl2):加过量Na2CO3溶液,过滤,再加适量盐酸并加热 | |
| B. | KNO3溶液(AgNO3):加过量KCl溶液,过滤 | |
| C. | NaCl溶液(Br2):加CCl4,分液 | |
| D. | NaCl溶液(KNO3):加热蒸发得浓溶液后,降温,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核内质子数为15的元素的最高正价为+3 | |
| B. | 电子层数相同时,最外层7个电子的元素非金属性最强 | |
| C. | 原子序数从11依次增加到17,原子半径逐渐增大 | |
| D. | 随着原子序数的增加,元素原子最外层电子数逐渐增多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com