
【题目】元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
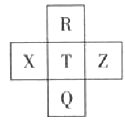
A. 非金属性:Z<T<X
B. R与Q的电子数相差26
C. 气态氢化物稳定性:R <T<Q
D. 最高价氧化物的水化物的酸性: X > T
【答案】B
【解析】试题分析:F 2与H 2在暗处剧烈化合并发生爆炸,生成HF,R为氟;由此可以推断X、T、Z、Q分别是硫、氯、氩、溴。Z、T、X分别是氩、氯、硫,稀有气体元素性质很稳定,同周期主族元素的非金属性随原子序数增大而递增,则非金属性:氩<硫<氯A项错误;R、Q分别是氟、溴,原子序数分别为9、35,氟和溴元素的原子序数相差35—9=26,由于元素的原子序数=原子的核外电子数,则氟和溴原子的电子数也相差26,B项正确;R、T、Q分别为氟、氯、溴,都是卤素,同主族非金属元素的非金属性随原子序数增大而减弱,则非金属性:氟>氯>溴,非金属性越强,气态氢化物越稳定,则HF>HCl>HBr或R>T>Q,C项错误;T、X分别是氯、硫,非金属性:氯>硫,非金属性越强,最高价氧化物的水化物酸性越强,则HClO 4的酸性比H2SO4强D项错误。


科目:高中化学 来源: 题型:
【题目】下列有关反应热的叙述中正确的是
①已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为△H=-241.8 kJ·mol-1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g)![]() Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
④已知:
共价键 | C—C | C===C | C—H | H—H |
键能/(kJ·mol-1) | 348 | 610 | 413 | 436 |
上表数据可以计算出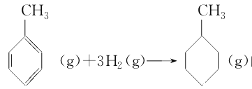 的焓变
的焓变
⑤根据盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1 mol CO2固体时,放出的热量相等
⑥25℃,101 kPa时,1 mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热
A.①②③④ B.③④⑤ C.④⑤ D.⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.已知2C(s)+2O2(g)=2CO2(g) ΔH=a kJ·mol-1;2C(s)+O2(g)=2CO(g) ΔH=b kJ·mol-1,则a>b
B.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1可知,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ
C.由C(石墨)=C(金刚石) ΔH=+1.9 kJ·mol-1可知,金刚石比石墨稳定
D.在100 kPa时,1 g H2完全燃烧生成液态水,放出285.8 kJ热量,则H2燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A和气体甲、乙、丙及物质B、C、D、E、F、G,它们之问能发生如下反应,其中乙是黄绿色气体(图中有些反应的产物和反应的条件没有全部标出)。
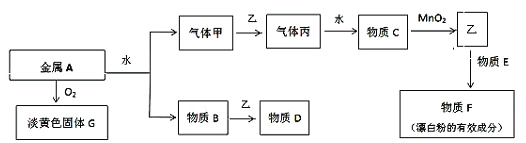
请根据以上信息回答下列问题:
(1)写出下列物质的名称:丙- ;
(2)写出下列物质的化学式:F________________;
(3)气体乙是一种重要的化工原料,在工农业牛产、牛活中有着重要的应用。请你根据所学
知识回答下列问题:
把气体乙通入紫色石蕊溶液中,可以观察到的现象是:__________,请你解释其中的原因 。
某化学兴趣小组计划用气体乙和物质B制取简易消毒液D。其反应原理为:(用化学方程式
表示)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质电离的叙述中正确的是( )
A.CaCO3在水中溶解度很小,其导电能力很弱,所以CaCO3是弱电解质
B.CaCO3在水中溶解度很小,但溶解的CaCO3全部电离,所以CaCO3是强电解质
C.氯气和氨气的水溶液导电性都很好,所以它们是强电解质
D.水难电离,纯水几乎不导电,水是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把下列四种物质分别加入到盛有100 mL蒸馏水的烧杯中,不能使蒸馏水导电性发生明显变化的是( )
A.10 g NaCl固体
B.10 g NaOH固体
C.10 g BaSO4固体
D.10 g Cu(NO3)2固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )
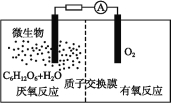
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项关于强电解质、弱电解质、非电解质的归类,完全正确的是
选项 | 强电解质 | 弱电解质 | 非电解质 |
A | CaCO3 | HF | SO2 |
B | NaCl | NH3 | BaSO4 |
C | Fe | HCl | 蔗糖 |
D | HNO3 | Fe(OH)3 | MgO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。
(1)高湿条件下,写出大气中SO2转化为HSO3-的方程式: 。
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
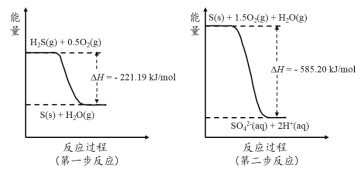
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为 。
(3)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如下:
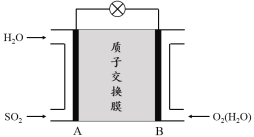
① 质子的流动方向为 (“从A到B”或“从B到A”)。
② 负极的电极反应式为 。
(4)燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。SO2烟气脱除的一种工业流程如下:
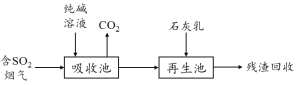
用纯碱溶液吸收SO2将其转化为HSO3-,反应的离子方程式是 。
若石灰乳过量,将其产物再排回吸收池,其中可用于吸收SO2的物质的化学式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com