
合成氨反应N2(g)+3H2(g)
 2NH3(g)在某温度下达平衡时,各物质的浓度是[N2]=3 mol·L-1,[H2]=9 mol·L-1,[NH3]=4 mol·L-1,求该温度时的平衡常数和N2、H2的起始浓度。
2NH3(g)在某温度下达平衡时,各物质的浓度是[N2]=3 mol·L-1,[H2]=9 mol·L-1,[NH3]=4 mol·L-1,求该温度时的平衡常数和N2、H2的起始浓度。
科目:高中化学 来源: 题型:
下列推断可能合理的是( )
A.Fe3+、O2、H2O2三种微粒只具有氧化性,没有还原性
B.木炭与浓硝酸反应可能生成CO和NH4NO3
C.因为SO2具有还原性,所以不能用浓H2SO4干燥SO2
D.Cl2转变为HClO时一定需要加入氧化剂才能实现
查看答案和解析>>
科目:高中化学 来源: 题型:
已知甲烷隔绝空气在不同温度下可能发生如下两个裂解反应:
①CH4(g)→C(s)+2H2(g)
②2CH4(g)→C2H2(g)+ 3H2(g)
3H2(g)
某同学为了得到用天然气制取炭黑的允许温度范围和最佳温度,在图书馆查到如下热力学数据:
反应①的ΔH(298 K)=74. 848kJ·mol-1,
848kJ·mol-1,
ΔS(298 K)=80.674 J·mol-1·K-1;
反应②的ΔH(298 K)=376.426 kJ·mol-1,
ΔS(298 K)=220.211 J·mol-1·K-1。
已知焓变和熵变随温度变化很小。请帮助这位同学解决如下问题:
(1)制取炭黑的反应是___________(填“高温”或“低温”)自发反应。
(2)通过计算判断制取炭黑的反应在常温下能否自发进行。
(3)求制取炭黑的允许温度范围。
查看答案和解析>>
科目:高中化学 来源: 题型:
在含Na2CO3和NaHCO3各1 mol的混合溶液中加入0.5 mol下列物质,其中能使HC 的数目减少,C
的数目减少,C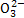 数目增加的是( )
数目增加的是( )
A.HCl B.Na2SO4 C.NaOH D.BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组为探究铜与浓硫酸的反应,用下图所示装置进行有关实验。甲同学取ag铜片和12 mL 18 mol·L-1浓硫酸放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的H2SO4和Cu剩余。
(1)Cu与浓硫酸反应的化学方程式是___________________________。
装置E中试管D内盛有品红溶液,当C中气体集满后,D中有可能观察到的现象是__________________________________,为避免实验装置D有可能造成的环境污染,可用浸有NaOH溶液的棉花团塞在试管口,其反应原理是_________(用离子方程式表示)。
(2)装置B的作用是贮存多余的气体,B中应放置的液体是______(填序号)。
a.饱和Na2SO3溶液 b.酸性KMnO4溶液
c.浓溴水 d.饱和NaHSO3溶液
当D处有明显现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是_________________________________________。
(3)反应完毕后,烧瓶中还有一定量的余酸,却不能使Cu完全溶解的原因是
____________________________;使用足量的下列药品不能用来证明反应结束后的烧瓶中的确有余酸的是______(填序号)。
a.铁粉 b.BaCl2溶液
c.CuO d.Na2CO3溶液
实验中某学生向A中反应后溶液中通入一种常见气体单质,使铜片全部溶解且仅生成硫酸铜溶液,该反应的化学方程式是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
放热反应CO(g)+H2O(g)
 CO2(g)+H2(g)在温度t1时达到平衡,[CO]1=[H2O]1=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为[CO]2和[H2O]2,平衡常数为K2,则( )
CO2(g)+H2(g)在温度t1时达到平衡,[CO]1=[H2O]1=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为[CO]2和[H2O]2,平衡常数为K2,则( )
A.若增大CO浓度,K2和K1都增大 B.K2>K1
C.[CO]2=[H2O]2 D.[CO]1>[CO]2
查看答案和解析>>
科目:高中化学 来源: 题型:
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是( )
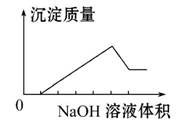
A.Mg2+、Al3+、Fe2+ B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+ D.只有Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机物的叙述不正确的是( )
A.甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同
B.将溴水加入苯中,溴水的颜色变浅,这是由于发生了加成反应
C.油脂和纤维素都能发生水解反应
D.甲烷、苯、乙醇都可以发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
氢氧燃料电池用于航天飞机,电极反应产生的水经冷凝后可作为航天员的饮用水,其电极反应式如下:

负极:2H2+4OH-—→4H2O+4e-
正极:O2+2H2O+4e-—→4OH-
当得到1.8 L饮用水时,电池内转移的电子数约为( )
A.1.8 mol B.3.6 mol C.100 mol D.200 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com