


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、加热煮沸MgCO3悬浊液,最终得到Mg(OH)2沉淀,说明Ksp(MgCO3)<Ksp[Mg(OH)2] |
| B、胆矾晶体投入浓硫酸中变成白色固体是化学变化 |
| C、电解AlCl3水溶液,阴极周围出现白色胶状沉淀,说明Al(OH)3胶体粒子带正电荷 |
| D、气体甲通入溶液乙,溶液乙颜色褪去,说明气体甲一定有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,原溶液一定有SO42- |
| B、滴入KMnO4酸性溶液,紫红色褪去,证明CH2=CHCH2CHO中一定有碳碳不饱和键 |
| C、能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 |
| D、加入稀盐酸,产生无色并能使澄清石灰水变浑浊的气体,原溶液一定有CO32-或SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 500℃ |
| 催化剂 |
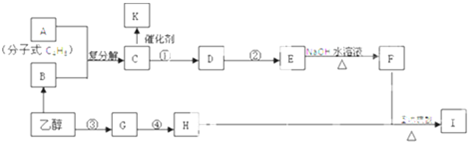
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲溶液为硝酸银溶液 |
| B、乙溶液为碳酸钠溶液 |
| C、丙溶液为氯化钠溶液 |
| D、乙溶液与丙溶液混合也会生成沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将铜粉与硫粉混合均匀加热以制取CuS |
| B、向Cu与过量浓硫酸反应后的试管中加水以观察CuSO4溶液的颜色 |
| C、向CuSO4溶液中加入过量的NaOH,过滤洗涤并收集沉淀充分灼烧以制取CuO |
| D、在淀粉溶液中加入适量稀H2SO4微热,再加少量新制Cu(OH)2悬溶液并加热,产生红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该弱酸溶液的pH=4 |
| B、加入NaOH溶液后,弱酸的电离平衡向右移动,但Ka不变 |
| C、加入等体积的0.01mol?L-1NaOH溶液后,所得的溶液的pH<7 |
| D、该弱酸的钠盐溶液一定会发生水解,常温下,其水解平衡常数Kh=10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com