
| A、若a>7,则一定有V<20 |
| B、若a=7,则一定有c(Na+)=c(X-) |
| C、若V<20,则一定有c(Na+)>c(X-)>c(OH-)>c(H+) |
| D、若V=20,则一定有c(Na+)+c(H+)=c(HX)+c(X-)+c(OH+) |


 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案科目:高中化学 来源: 题型:

| A、b、d、f四种元素的原子半径:b>f>d |
| B、元素b的单质不能与酸性氧化物发生化学反应 |
| C、元素c的氧化物既能与酸反应,又能与碱反应 |
| D、a、c、e的最高价氧化物对应的水化物之间能够相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢键是一种化学键 |
| B、氢键使物质具有较高的熔、沸点 |
| C、能与水分子形成氢键的物质易溶于水 |
| D、水结成冰体积膨胀与氢键无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、粘胶纤维、铜氨纤维、涤纶、光导纤维都是有机高分子材料 |
| B、N7H9禽流感病毒并不可怕,人只要喝一定量盐水,就能杀死该病毒 |
| C、有一种新发现的固态碳,称为“纳米泡沫”,外形似海绵,密度小、有磁性,它与金刚石都属于碳的同素异形体 |
| D、分子间作用力比化学键弱得多,它对物质的熔点、沸点有较大影响,但对溶解度无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、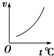 |
B、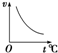 |
C、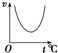 |
D、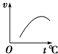 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用浓HNO3与Cu反应制备NO2 |
| B、用BaCl2溶液鉴别CO2与SO2 |
| C、用溴水鉴别苯和正已烷 |
| D、将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二者在水中的溶解度不同,碳酸氢钠的溶解度大于碳酸钠的溶解度 |
| B、二者热稳定性不同,碳酸钠的热稳定性大于碳酸氢钠的热稳定性 |
| C、二者都能与盐酸反应放出二氧化碳气体,但产气量和反应快慢不同 |
| D、二者在一定的条件下可以相互转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com