
| A. | KI被氧化成KOH | |
| B. | KI是离子化合物,I2是共价化合物 | |
| C. | 1 mol O3 在反应中得到4 mol 电子 | |
| D. | KOH中既有离子键又有共价键 |
分析 该反应中碘元素化合价由-1价变为0价,氧元素的化合价由0价变为-2价,根据物质间的关系分析解答,注意臭氧和氧气中化合价相同.
解答 解:A.I元素的化合价升高,在反应中被氧化成I2,则KI被氧化成I2,故A错误;
B.KI是钾离子和碘离子通过离子键形成的为离子化合物,I2是碘原子间通过共用电子对形成的单质,不是化合物,故B错误;
C.1 mol O3反应时只有1 mol O原子被还原,所以1 mol O3 在反应中得到2mol 电子,故C错误;
D.KOH是钾离子和氢氧根离子通过离子键形成的为离子化合物,氢氧根离子由氢原子和氧原子通过共用电子对形成的,所以KOH中既有离子键又有共价键,故D正确;
故选D.
点评 本题考查氧化还原反应及其化学键的判断,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 硅是亲氧元素,在自然界中以化合态存在 | |
| B. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有元素中居第一位 | |
| C. | 硅的活泼性比碳强,只有在高温下才能跟氢气起化合反应 | |
| D. | 二氧化硅在电子工业中,是重要的半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 结论 | |
| A | 用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中 | 出现白色沉淀 | 非金属性:Cl>C>S |
| B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42-、SO32-、HSO32-中的一种或几种 |
| C | 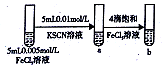 | 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
| D | 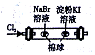 | 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它的原子半径比钠大,失电子能力不如钠 | |
| B. | 它的金属性比钠强,跟水反应会更剧烈 | |
| C. | 它的氢氧化物(FrOH)是一种强碱,遇酚酞溶液变红 | |
| D. | 它可与硫酸铜溶液反应,但是不易得到金属铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水清除试管壁附着的银镜 | |
| B. | 用氢氧化钠溶液清洗沾在皮肤上的苯酚 | |
| C. | 用食醋清除暖瓶水垢(主要成分碳酸钙) | |
| D. | 用碳酸钠溶液清除钢铁制品表面的铁锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
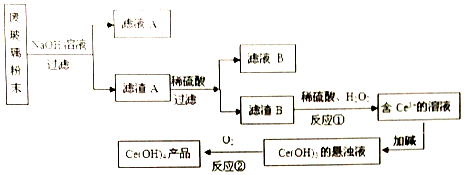
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol•L-1 NaCl溶液中含有Na+个数为NA | |
| B. | 标准状况下,22.4 L H2O含有的水分子数为NA | |
| C. | 71g氯气与足最铁粉充分反应,转移的电子数为3NA | |
| D. | 标准状况下,16g O2和O3的混合气体中原子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W的最高价氧化物是大气污染物之一 | |
| B. | X、Y、Z的离子半径逐渐增大 | |
| C. | X的最高价氧化物的水化物能分别与Y、Z的最高价氧化物对应水化物反应 | |
| D. | 最简单氢化物的热稳定性:Z>W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com