
【题目】苯乙稀(![]() )是重要的有机化工原料。工业上以乙苯(
)是重要的有机化工原料。工业上以乙苯(![]() )为原料,采用催化脱氢的方法制取苯乙稀的化学方程式为:
)为原料,采用催化脱氢的方法制取苯乙稀的化学方程式为:![]() △H=124kJ·mol-1
△H=124kJ·mol-1
(1)25℃、101 kPa 时,1 mol 可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热。 已知:H2 和苯乙烯的燃烧热 △H 分别为-290 kJ·mol -1 和-4400 kJ·mol-1,则乙苯的燃烧热△H=_____kJ·mol-1。
(2)在体积不变的恒温密闭容器中,发生乙苯催化脱氢的反应,反应过程中各物质浓度随时间变化的关系如图所示。 在 t1 时刻加入 H2,t2 时刻再次达到平衡。
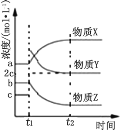
①物质 X 为_____,判断理由是_____;
②乙苯催化脱氢反应的化学平衡常数为_____(用含 a、b、c 的式子表示)。
(3)在体积为 2 L 的恒温密闭容器中通入 2 mol 乙苯蒸气,2 min 后达到平衡,测得氢气的浓度是 0.5 mol·L-1,则乙苯蒸气的反应速率为_____;维持温度和容器体积不变,向上述平衡中再通入 1.5 mol 氢气和 1.5 mol 乙苯蒸气,则 v 正______v 逆(填“大于”、“小于”或“等于”)。
(4)实际生产时反应在常压下进行,且向乙苯蒸气中掺入水蒸气,利用热力学数据计算得到温度和投料比(M)对乙苯的平衡转化率的影响如图所示。[M=![]() ]
]
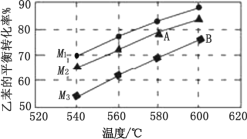
①比较图中 A、B 两点对应的平衡常数大小:KA_____KB(填“>”、“<”或“=”);
②图中投料比 M1、M2、M3 的大小顺序为_____。
【答案】-4566 乙苯 加入 H2 后平衡向左移动,乙苯浓度逐渐增大 ![]() molL-1 0.25 mol·L-1·min-1 等于 < M1>M2>M3
molL-1 0.25 mol·L-1·min-1 等于 < M1>M2>M3
【解析】
(1)①![]() (g)+10O2(g)=8CO2(g)+4H2O(l) △H1 =-4400 kJ·mol-1
(g)+10O2(g)=8CO2(g)+4H2O(l) △H1 =-4400 kJ·mol-1
②H2(g)+![]() O2(g)= H2O(l) △H2 =-290 kJ·mol-1
O2(g)= H2O(l) △H2 =-290 kJ·mol-1
③![]() △H3=124kJ·mol-1
△H3=124kJ·mol-1
①+②+③得到![]() +
+![]() O2(g)=8CO2(g)+5H2O(l)△H=△H1+△H2+△H3=-4566 kJ·mol-1。
O2(g)=8CO2(g)+5H2O(l)△H=△H1+△H2+△H3=-4566 kJ·mol-1。
(2)在t1时刻加入H2,氢气的物质的量浓度增大,且平衡逆向移动,导致苯乙烯的浓度减小,然后氢气的浓度减小,但苯乙烷的浓度比原来的大,结合图可知X为乙苯,浓度为a,Y为氢气,浓度为c,Z为苯乙烯,浓度为b,反应![]() 化学平衡常数等于平衡时生成物的浓度幂之积与反应物的浓度幂之积,K=
化学平衡常数等于平衡时生成物的浓度幂之积与反应物的浓度幂之积,K=![]() molL-1;
molL-1;
(3)根据反应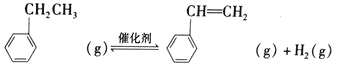 ,达到平衡时,氢气的浓度是 0.5 mol·L-1,则
,达到平衡时,氢气的浓度是 0.5 mol·L-1,则 也为0.5 mol·L-1,
也为0.5 mol·L-1,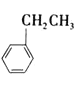 为1mol·L-1-0.5 mol·L-1=0.5 mol·L-1,乙苯蒸汽的反应速率为
为1mol·L-1-0.5 mol·L-1=0.5 mol·L-1,乙苯蒸汽的反应速率为![]() =0.25molL1min1,K=
=0.25molL1min1,K=![]() =0.5,维持温度和容器体积不变,向上述平衡中再通入1mol氢气和1mol乙苯蒸汽,Qc=
=0.5,维持温度和容器体积不变,向上述平衡中再通入1mol氢气和1mol乙苯蒸汽,Qc=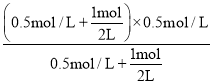 =0.5=K,平衡不移动,则v正等于v逆;
=0.5=K,平衡不移动,则v正等于v逆;
(4)①由上述计算可知,焓变为正,为吸热反应,温度越高,K越大,B比A的温度高,则KA<KB;
②因体积增大、压强减小,有利于平衡正向移动,平衡转化率增大,则相同温度时M越大时平衡转化率越大,即M1>M2>M3。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】阿魏酸是传统中药当归、川穹的有效成分之一,工业上合成阿魏酸的原理如下,下列说法不正确的是
 +H2O+CO2
+H2O+CO2
A.阿魏酸分子式为C10H10O4
B.阿魏酸存在顺反异构
C.方程式中三种有机物均可与NaOH、Na2CO3反应
D.可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置中所用仪器、试剂、现象和结论均正确的是
选项 | 装置 | 现象 | 结论 |
A |
| 装置Ⅲ中有浅黄色沉淀生成 | 苯和浓溴水发生取代反应 |
B |
| 高锰酸钾溶液褪色,溴的四氯化碳溶液褪色 | 石蜡油的分解产物中含有乙烯 |
C |
| 分液漏斗液体流下,锥形瓶中产生大量气体 | 快速制备和收集一定量的氨气 |
D |
| 试管中依次出现白色,黄色沉淀 | 说明 Ksp(AgCl)>Ksp(AgI) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.某温度时 N2(g)+3H2(g)![]() 2NH3(g),正、逆反应的平衡常数分别为 K1、K2,则 K1·K2=1
2NH3(g),正、逆反应的平衡常数分别为 K1、K2,则 K1·K2=1
B.若一个可逆反应的化学平衡常数很大,则该反应会在较短的时间内完成
C.氢氧燃料电池是一种将热能转化为电能的装置
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
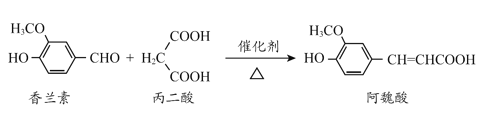
【题目】酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如下图所示。反应原理为:CH3CH2OH+O2=CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法正确的是( )
A.电解质溶液中的H+移向a电极
B.b为正极,电极反应式为:O2+4H++4e-=2H2O
C.若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气
D.呼出气体中酒精含量越高,微处理器中通过的电流越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将某一元酸 HA 和 NaOH 溶液等体积混合,两种溶液的浓度和混合后所得溶液的 pH 如表:
实验编号 | HA物质的量浓度/(molL-1) | NaOH物质的量浓度/( molL-1) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.2 | pH=a |
请回答:
(1)用离子方程式表示①组混合溶液显碱性的原因是_____。
(2)②组中c_____0.2(填“>”、“<”或“=”,下同);③组中 a_____9。
(3)常温下,HA 的电离平衡常数的值为_____。
(4)从以上实验分析,将 pH=11 的 NaOH 溶液与 pH=3 的 HA 溶液等体积混合,所得混合溶液中所有离子浓度由大到小的顺序为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A.2.8g14N2与14C16O的混合物中,中子数目为 l.4NA
B.含 0. l molFeCl3的溶液与0. l mol 锌充分反应,转移电子数为0.l NA
C.标准状况下,5.6gC4H8中 C-C 的数目可能为0.4NA
D.某温度下,1LpH=9 的 Na2CO3 溶液中,水电离产生的OH-数目为10-5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为 1.0L 的恒容密闭容器中发生反应: CH3OH(g)+CO(g) CH3COOH(g) △H<0。下列说法正确的是
容器编号 | 温度/K | 物质的起始浓度/mol/L | 乙酸的平衡浓度/ mol/L | 平衡常数 | ||
c(CH3OH) | c(CH3OH) | c(CH3COOH) | c(CH3COOH) | |||
I | 530 | 0.50 | 0.5 | 0 | 0..40 | K1 |
II | 530 | 0.20 | 0.2 | 0.4 | K2 | |
III | 510 | 0 | 0 | 0.5 | K3 | |
A.三个容器中的平衡常数 K1<K2< K3
B.达平衡时,容器I与容器II中的总压强之比为3 : 4
C.达平衡时,容器I中CH3OH转化率与容器 III 中CH3COOH转化率之和小于l
D.达平衡时,容器III中的正反应速率比容器I中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
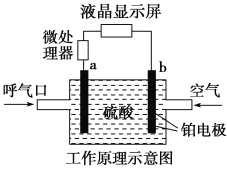
【题目】一种新型漂白剂(如下图)可用于漂白羊毛等,其中W、Y、Z为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述正确的是( )
A.工业上通过电解熔融的WX来制得W
B.W、X对应的简单离子半径顺序为:W>X
C.该漂白剂中各元素均满足8电子稳定结构
D.Y的最高价氧化物对应水化物为弱酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com