
| A.只有②③④ | B.只有②④ | C.只有④ | D.全部 |
科目:高中化学 来源:不详 题型:单选题
| A.除④外 | B.除④⑤⑥⑧外 | C.除④⑥外 | D.全部都可行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入适量的5mol/L的盐酸 | B.加入数滴氯化铜溶液 |
| C.加入适量蒸馏水 | D.加入适量氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 NH4+ +OH-的平衡,如果使平衡向逆反应方向移动,同时使c(OH-)增大,应加入
NH4+ +OH-的平衡,如果使平衡向逆反应方向移动,同时使c(OH-)增大,应加入| A.氯化铵固体 | B.硫酸 | C.NaOH固体 | D.大量水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验 编号 | T/K | 催化剂的用量 / g | 酸性KMnO4溶液的浓度/mol·L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a. 实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b. 实验①和 探究温度对该反应速率的影响; c. 实验①和 探究催化剂对该反应速率的影响。 |
| ② | | | | |
| ③ | | | | |
| ④ | | | |
| 实验编号 | 溶液褪色所需时间 t / min | ||
| 第1次 | 第2次 | 第3次 | |
| ① | 14.0 | 13.0 | 11.0 |
| ② | 6.0 | 7.0 | 7.0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

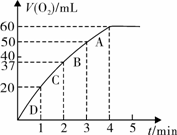
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na2CO3 | B.CH3COONa | C.NaOH | D.NaHCO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应速率通常只能用反应物浓度的减少量表示 |
| B.决定反应速率的主要因素是反应物的性质 |
| C.化学平衡状态指的是指化学反应不再进行的状态 |
| D.加入催化剂可加快化学反应速率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验编号 试剂 | A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/ mL | 0 | 5.0 | 10.0 |
| H2O/ mL | V3 | V4 | 0 |
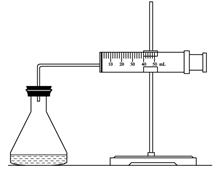
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com