
【题目】
苯酚是一种重要的化工原料,以苯酚为主要起始原料,经下列反应可制得香料M 和高分子化合物N(部分产物及反应条件已略去):
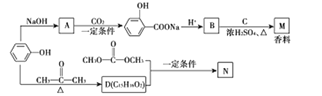
已知化合物N为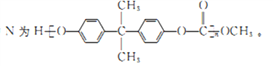
回答下列问题:
(1)B的结构简式为________________,B中能与NaHCO3反应的官能团名称是_______________。
(2)已知C的分子式为C5H12O,C能与金属Na反应,C的核磁共抓氢谱有3组峰,峰面积比值是9: 2:1,则M的结构简式为_________________。
(3)由苯酚生成D的化学方程式为______________________。
(4)化合物D与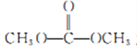 发生反应,除生成化合物N 外,还生成_____________(写结构简式)。 (5)F是相对分子质量比B大14的同系物,F有多种同分异构体,符合下列条件的F的同分异构体有_____种。①属于芳香族化合物 ②遇FeCl3 溶液显紫色,且能发生水解反应
发生反应,除生成化合物N 外,还生成_____________(写结构简式)。 (5)F是相对分子质量比B大14的同系物,F有多种同分异构体,符合下列条件的F的同分异构体有_____种。①属于芳香族化合物 ②遇FeCl3 溶液显紫色,且能发生水解反应
③苯环上有两个取代基
(6)已知: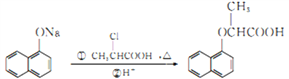 ,写出用苯酚、乙醇和ClCH2COOH为原料制备化合物
,写出用苯酚、乙醇和ClCH2COOH为原料制备化合物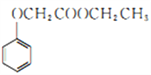 的合成路线_________________(其他试剂任选)。
的合成路线_________________(其他试剂任选)。
【答案】 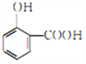 羧基
羧基 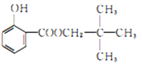
 CH3OH 9
CH3OH 9 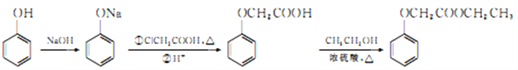
【解析】考查有机物合成与推断,(1)H+的酸性强于羧酸,因此生成B的原理是利用酸性强的制取酸性弱的,因此B的结构简式为 ;B中含有官能团是羧基和羟基,羧酸的酸性强于碳酸,因此能与NaHCO3反应的官能团名称为羧基;(2)C的分子式为C5H12O,能与金属Na发生反应,即C中含有羟基,C含羟基的结构简式可能是、
;B中含有官能团是羧基和羟基,羧酸的酸性强于碳酸,因此能与NaHCO3反应的官能团名称为羧基;(2)C的分子式为C5H12O,能与金属Na发生反应,即C中含有羟基,C含羟基的结构简式可能是、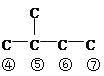 、
、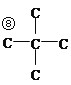 ,羟基位置有8种,有3组峰,且峰面积比值是9:2:1,因此C的结构简式为(CH3)3CCH2OH,B与C发生酯化反应,即M的结构简式为:
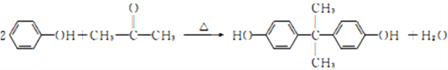
,羟基位置有8种,有3组峰,且峰面积比值是9:2:1,因此C的结构简式为(CH3)3CCH2OH,B与C发生酯化反应,即M的结构简式为: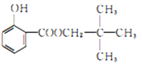 ;(3)根据D的分子式C15H16O2,以及N的结构简式,苯酚生成D的反应方程式为
;(3)根据D的分子式C15H16O2,以及N的结构简式,苯酚生成D的反应方程式为 ;(4)根据N的结构简式,生成N的类型为缩聚反应,除N外,还有CH3OH;(5)F的相对分子质量比B大14,因此F比B多一个“-CH2-”,属于芳香族化合物,说明含有苯环,遇FeCl3溶液显紫色,说明含有酚羟基,能发生水解反应,说明含有酯基,符合条件的结构简式为
;(4)根据N的结构简式,生成N的类型为缩聚反应,除N外,还有CH3OH;(5)F的相对分子质量比B大14,因此F比B多一个“-CH2-”,属于芳香族化合物,说明含有苯环,遇FeCl3溶液显紫色,说明含有酚羟基,能发生水解反应,说明含有酯基,符合条件的结构简式为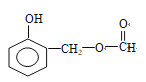 (邻间对三种)、
(邻间对三种)、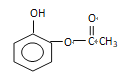 (邻间对三种)、
(邻间对三种)、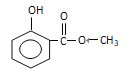 (邻间对三种),共有9种;(6)根据生成N和M的路线,此合成路线为
(邻间对三种),共有9种;(6)根据生成N和M的路线,此合成路线为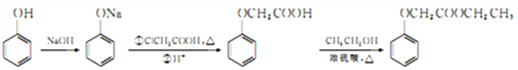 。
。


科目:高中化学 来源: 题型:
【题目】某短周期非金属元素,其原子核外最外层电子数是次外层电子数的一半,该元素( )
A.在自然界中以化合态的形式存在
B.单质常用作半导体材料
C.最高价氧化物不与任何酸反应
D.气态氢化物比甲烷稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表前四周期A、B、C、D、E五种元素,A元素的原子最外层电子排布式为ms1;B元素的原子价电子排布式为ns2np2;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素原子有五个未成对电子。
(1)写出E元素名称:________
(2)C基态原子的电子排布图为___________________,若A为非金属元素,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于________键(填“σ”或“π”)。
(3)当n=2时,BC分子的结构式是 ________;当n=3时,B与C形成的化合物与氢氧化钠溶液反应的离子方程式是______________。
(4)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,A、B、C、D四种元素的第一电离能由大到小的顺序是__________________(用元素符号表示)。
(5)E元素原子的价电子排布式是________,在元素周期表中位置是______________,其最高价氧化物的化学式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蒸馏是实验室制备蒸馏水的常用方法,如图所示的两个装置都可以制取蒸馏水。

(1)图I是实验室制取蒸馏水的常用装置,仪器A的名称是________________,加热A时要加垫石棉网,目的是_______________。
(2)水的流向是否正确?________(填“正确”或“不正确”)
(3)实验时A中除加入少量自来水外,还需加入少量___________,其作用是____________。
(4)图Ⅱ装置也可用于少量蒸馏水的制取(加热及固定仪器略),其原理与图I完全相同。该装置中使用的玻璃导管较长,其作用是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。电解铝时阳极产生的CO2可通过二氧化碳甲烷化再利用。
请回答:
(1)已知:2Al2O3(s)===4Al(g)+3O2(g) ΔH1=3 351 kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH2=-221 kJ·mol-1
2Al(g)+N2(g)===2AlN(s) ΔH3=-318 kJ·mol-1
碳热还原Al2O3合成AlN的总热化学方程式是________________________,
该反应自发进行的条件________。
(2)在常压、Ru/TiO2催化下,CO2和H2混合气体(体积比1∶4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应Ⅰ CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) ΔH4
CH4(g)+2H2O(g) ΔH4
反应Ⅱ CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH5
CO(g)+H2O(g) ΔH5
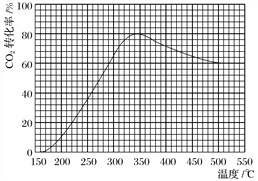
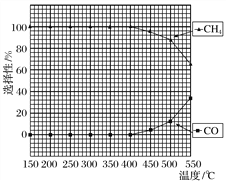
图1 图2
①下列说法不正确的是________。
A.ΔH4小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1∶3,可提高CO2平衡转化率
②350 ℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为V L,该温度下反应Ⅰ的平衡常数为________(用a、V表示)。
③350 ℃下CH4物质的量随时间的变化曲线如图3所示。画出400 ℃下0~t1时刻CH4物质的量随时间的变化曲线。__________________________
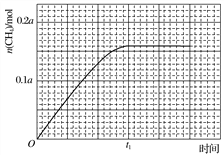
图3
(3)据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能大量共存的是( )
A.Al3+、K+、OH﹣、NO3﹣
B.Ba2+、Na+、SO42﹣、OH﹣
C.H+、K+、CH3COO﹣、Cl﹣
D.K+、Na+、Cl﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com