

分析 (1)①根据A、B两组与水反应方程式的特征分析;
②C组物质与水反应水只作氧化剂的只有钠;
③D组物质与水反应中,根据氧化剂和还原剂物质的量之比为1:1来分析;
(2)①H2O2仅体现氧化性,则O元素的化合价降低;双氧水仅体现还原性,说明双氧水在反应中仅被氧化,化合价只升高;H2O2既体现氧化性又体现还原性,则O元素的化合价既升高又降低;H2O2既不做氧化剂又不做还原剂,说明在反应中双氧水的化合价不发生变化;
②过氧化氢为常见的强氧化剂;
③根据双氧水做氧化剂的还原产物为水,无污染产物判断;
(3)Cu由+2价降低为0,N元素的化合价由-3价升高为0,由电子守恒、原子守恒分析.
解答 解:(1)①A组与水反应都是生成对应的酸或者碱,而B组与水反应都发生了氧化还原反应,故分成A、B两组的依据是与水反应是否是氧化还原反应,
故答案为:与水反应是否是氧化还原反应;
②C组物质与水反应水只作氧化剂的只有钠,所以离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故答案为:2Na+2H2O═2Na++2OH-+H2↑;
③D组物质与水反应中,水即不作氧化剂也不作还原剂的为Cl2、Na2O2,其中氧化剂和还原剂物质的量之比为1:1也是Cl2、Na2O2,故答案为:Cl2、Na2O2;
(2)①A.Na2O2+2HCl=2NaCl+H2O2,是一个非氧化还原反应,双氧水既不是氧化剂,也不是还原剂,故A不选;
B.Ag2O+H2O2=2Ag+O2↑+H2O,Ag2O被还原成单质银,H2O2仅表现为还原性,其中氧元素转化为O2,故B不选;
C.2H2O2=2H2O+O2↑,过氧化氢的分解反应,是一个自身氧化还原反应,H2O2既表现了氧化性,又表现了还原性,故C选;
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O,双氧水在反应中化合价由-1变成-2,化合价降低被还原,双氧水仅做氧化剂,故D不选;
故答案为:C;
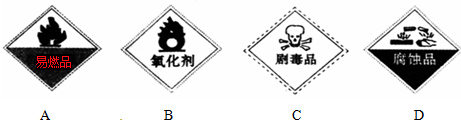
②过氧化氢为常见的强氧化剂,无毒、不具有腐蚀性,也不自燃,则只有B中标签符合,故答案为:B;
③双氧水做氧化剂的还原产物为水,无污染,故答案为:H2O2是氧化剂,其产物是H2O,H2O没有毒性及污染性;
(3)①Cu由+2价降低为0,N元素的化合价由-3价升高为0,由电子守恒、原子守恒可知,NH4Cl失去3个电子,而铜得到2个电子,得失电子守恒,NH4Cl前面系数为2,铜前面的系数为3,再结合原子守恒可知,反应为4CuO+2NH4Cl=3Cu+CuCl2+N2+4H2O,故答案为:4;2;3;1;1;4;
②由反应可知,生成1mol气体转移6mol电子,则产生0.2mol的气体转移的电子为0.2mol×6mol=1.2mol,故答案为:1.2.
点评 本题考查物质的性质及氧化还原反应,为高频考点,把握物质的性质、习题中的信息及发生的反应为解答的关键,侧重分析与应用能力的考查,注重氧化还原反应的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,反应过程中得到7.84 L的气体 | |
| B. | 最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) | |
| C. | 最终得到7.8 g的沉淀 | |
| D. | 最终得到的溶液中c(Na+)=1.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 向100mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),测得最后溶液的pH>7.
向100mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),测得最后溶液的pH>7.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X<W<Y<Z | |
| B. | X的氢化物稳定性大于Z的氢化物稳定性 | |
| C. | X在自然界中只能以化合态形式存在 | |
| D. | W的单质可使干燥的红色布条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数:c>d | B. | 离子的还原性:Z->Y2- | ||
| C. | 氢化物的稳定性:H2Y>HZ | D. | 离子半径:X+<Y2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
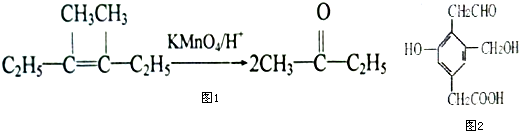
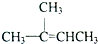 在上述条件下发生反应,得到的最终产物结构式分别是:
在上述条件下发生反应,得到的最终产物结构式分别是: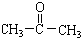 、
、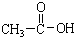
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com