
【题目】电解原理在化学工业中有着广泛的应用。下图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
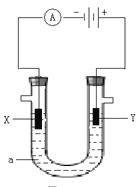
(1)若用U型管电解滴有酚酞的饱和食盐水,电解一段时间后,_________极(选填X或Y)附近溶液呈红色, Y极产生的现象是______________________,电解前溶液的pH_______7(填“大于”、“小于”或“等于”,下同),电解后溶液的pH_________7。
(2)写出电解饱和食盐水的化学方程式____________________________________________ 。
(3)若a是CuCl2溶液,则Y极上的产物是____________。X极现象____________________________。
【答案】X 产生黄绿色气体 等于 大于 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ Cl2 析出紫红色金属
2NaOH+H2↑+Cl2↑ Cl2 析出紫红色金属
【解析】
(1)X电极上氢离子放电生成氢气,同时电极附近生成氢氧根离子,导致溶液呈碱性,酚酞遇碱变红色;Y电极上氯离子放电生成氯气;
(2)惰性电极电解饱和食盐水生成NaOH、氯气和氢气;
(3)若a是CuCl2溶液,Cu2+在X极上得电子发生还原反应,Cl-在Y极上发生氧化反应。
(1)和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,所以该电极附近氢氧根浓度增大,碱性增强,滴入几滴酚酞试液会变红;Y极为阳极,溶液中Cl-在Y极上发生氧化反应生成氯气,现象是产生黄绿色气体,电解前NaCl溶液呈中性,溶液的pH等于7,电解后生成NaOH,溶液的pH大于7;
(2)惰性电极电解饱和食盐水生成NaOH、氯气和氢气,发生反应的化学方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
(3)若a是CuCl2溶液,Cu2+在X极上得电子发生还原反应,Cl-在Y极上发生氧化反应,则Y极上的产物是Cl2;X极看到的现象是析出紫红色金属。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】已知 3.6 g 碳在 6.4 g 的氧气中燃烧,至反应物耗尽,并放出 X kJ 热量。已知单质 C(s)的燃烧热数值为 Y kJ·mol-1,则 1 mol C(s)与 O2(g)反应生成 CO(g)的反应热 ΔH 为( )
A. -Y kJ/mol B. -(10X-Y) kJ/mol C. -(5X-0.5Y) kJ/mol D. +(10X-Y) kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲同学设计实验探究碳、硅元素的非金属性的相对强弱,实验装置如图。根据要求完成下列各题。
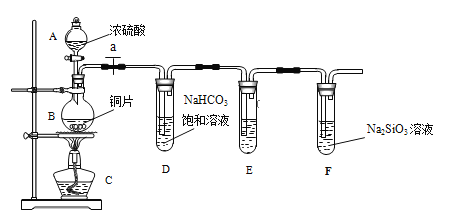
(1)填写所示仪器名称:A__________,B__________。
(2)实验步骤:连接仪器、______________、加药品后,打开 a、滴入浓硫酸,加热。
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是________________________________;装置E中装的是酸性KMnO4溶液,其作用是_____________________________;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是__________________。
③依据试管 D 中的反应,能否证明S的非金属性强于C的非金属性___(填 “能”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
时间(min) | 0 | t1 | t2 | t3 |
NH3物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min,v(NH3)=0.2/t1mol·L-1·min-1
B. t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1
C. N2(g)+3H2(g) ![]() 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g) ![]() N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】勒夏特列原理在生产生活中有许多重要应用。完成下列填空:
(1)实验室配置FeCl3溶液时,将FeCl3溶解在盐酸中,目的是防止________________________。
(2)石蕊(用HZ表示)试液中存在的电离平衡HZ(红色)![]() H++Z—(蓝色)。在中性溶液中。石蕊试液呈__________色;要使石蕊试液呈红色,可加入____________________________。
H++Z—(蓝色)。在中性溶液中。石蕊试液呈__________色;要使石蕊试液呈红色,可加入____________________________。
(3)工业制硫酸时,为使SO2尽可能多地转化成SO3,采取的措施是_______________________。
(4)合成氨工业采取的以下措施中,可以用勒夏特列原理解释的是_________(选填编号)。
a.升温至500℃左右 b.使用催化剂
c.加压至20~50MPA. d.将氨及时液化分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As的原子结构示意图为![]() ,下列关于As的描述不正确的是 ( )
,下列关于As的描述不正确的是 ( )
A. 位于第四周期,第ⅤA族 B. 属于非金属元素
C. 酸性:H3AsO4﹥H3PO4 D. 稳定性:AsH3﹤PH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的措施是( )
A. 向水中通入SO2 B. 将水加热煮沸
C. 向纯水中投入一小块金属钠 D. 向水中加入NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiFePO4可作为新型锂离子也池的正极材料。以钛铁矿(主要成分为FeTiO3、Fe2O3及少量CuO、SiO2杂质)为主要原料生产TiOSO4,同时得到的绿矾(FeSO4·7H2O)与磷酸和LiOH反应可制各 LiFePO4, LiFePO4的制备流程如下图所示:

请回答下列问题:
(1)酸溶时 FeTiO3与硫酸反应的化学方程式可表示为____________________。
(2)①加铁屑还原的目的是__________,②过滤前需要检验还原是否完全,其实验操作可描述为_________。
(3)①“反应”需要按照一定的顺序加入FeSO4溶液、磷酸和LiOH,其加入顺序应为____________________,②其理由是______________________________。
(4)滤渣中的铜提纯后可用于制取Cu2O,Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应:2Cu+H2O![]() Cu2O+H2↑。则该装置中铜电极应连接直流电源的__________极,石墨电极的电极反应式为____________________,当有0. 1mol Cu2O生成时电路中转移__________mol电子。
Cu2O+H2↑。则该装置中铜电极应连接直流电源的__________极,石墨电极的电极反应式为____________________,当有0. 1mol Cu2O生成时电路中转移__________mol电子。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com