
【题目】工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示.钛铁矿主要成分为钛酸亚铁(FeTiO3),其中一部分铁元素在风化过程中会转化为+3价. 
已知:TiOSO4遇水会水解.
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为 .
(2)步骤③中,实现混合物的分离是利用物质的(填字母序号). a.熔沸点差异 b.溶解性差异 c.氧化性、还原性差异
(3)步骤②、③、④中,均需用到的操作是(填操作名称).
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为H2TiO3的原理: .
(5)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4 , 易溶于水),该反应的离子方程式为 .
(6)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2﹣CaO作电解质,利用如下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛. 
①写出阳极所发生反应的电极反应式: .
②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释) .
【答案】
(1)2Fe3++Fe═3Fe2+
(2)b
(3)过滤
(4)溶液中存在平衡:TiO2++2H2O?H2TiO3+2H+ , 当加入热水稀释、升温后,平衡正向移动,生成H2TiO3
(5)MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O
(6)2O2﹣﹣4e﹣═O2↑;制备TiO2时,在电解槽发生如下反应:2CaO═2Ca+O2↑,2Ca+TiO2 ![]() Ti+2CaO,由此可见,CaO的量不变
Ti+2CaO,由此可见,CaO的量不变
【解析】解:(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为:2Fe3++Fe=3Fe2+ , 所以答案是:2Fe3++Fe═3Fe2+;(2)步骤③冷却结晶得到硫酸亚铁晶体,利用的是物质溶解度的不同,通过冷却热饱和溶液得到,所以答案是:b;(3)②③④步骤的操作过程中都得到沉淀或晶体,所以需要过滤得到固体和溶液,所以答案是:过滤;(4)④中使用热水的目的是促进TiO2+水解生成H2TiO3 , 分离出固体加热得到TiO2;溶液中存在平衡:TiO2++2H2OH2TiO3+2H+ , 当加入热水稀释、升温后, 平衡正向移动,生成H2TiO3;
所以答案是:溶液中存在平衡:TiO2++2H2OH2TiO3+2H+ , 当加入热水稀释、升温后,平衡正向移动,生成H2TiO3 . (5)利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4 , 易溶于水),利用二氧化锰的氧化性氧化亚铁离子为三价铁离子,反应的离子方程式为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
所以答案是:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;(6)①用石墨作阳极、钛网作阴极、熔融CaF2﹣CaO作电解质,阳极发生氧化反应,阴极析出钙金属发生还原反应,阳极图示产物可可知,阳极生成二氧化碳气体,是电解质中的氧离子失电子生成氧气,氧气和阳极石墨反应生成的二氧化碳,所以电极反应为:2O2﹣﹣4e﹣=O2↑,或C+2O2﹣﹣4e﹣=CO2↑;
所以答案是:2O2﹣﹣4e﹣=O2↑,或C+2O2﹣﹣4e﹣=CO2↑;
②制备TiO2时,在电解槽发生如下反应:2CaO═2Ca+O2↑,2Ca+TiO2 ![]() Ti+2CaO,由此可见,CaO的量不变;
Ti+2CaO,由此可见,CaO的量不变;
或:制备TiO2时,在电解槽发生如下反应:阴极:2Ca2++4e﹣═2Ca 阳极:2O2﹣﹣4e﹣═O2↑;2Ca+TiO2 ![]() Ti+2CaO,由此可见,CaO的量不变;
Ti+2CaO,由此可见,CaO的量不变;
所以答案是:制备TiO2时,在电解槽发生如下反应:2CaO═2Ca+O2↑,2Ca+TiO2 ![]() Ti+2CaO,由此可见,CaO的量不变.
Ti+2CaO,由此可见,CaO的量不变.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)→2NH3(g)+CO2(g).判断该分解反应已经达到化学平衡的是( )
A.密闭容器中混合气体的密度不变
B.密闭容器中c(NH3):c(CO2)=2:1
C.2v(NH3)=v(CO2)
D.密闭容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空 
(1)根据图1请写出合成氨的热化学方程式(热量用E1、E2或E3表示).
(2)实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(Ls)]与反应时间t(s)的关系如图2所示.该反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O,回答如下问题:
①0→t2时间段内反应速率增大的原因是: ,
②t2→t时间段内反应速率减小的原因是: ,
③图中阴影部分“面积”表示t1→t3时间里 .
A.Mn2+物质的量浓度的增大 B.Mn2+物质的量的增加
C.SO42﹣物质的量浓度 D.MnO4﹣物质的量浓度的减小.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下,下列叙述正确的是( )
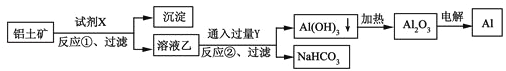
A. 试剂X氢氧化钠溶液
B. 反应①、过滤后所得沉淀为红褐色Fe2O3
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HgCl2的稀溶液可用作手术刀的消毒剂,已知熔融的HgCl2不导电,而HgCl2的稀溶液有弱的导电能力,下列关于HgCl2的叙述正确的是 ( )
A.HgCl2属于离子化合物B.HgCl2属于共价化合物
C.HgCl2属于非电解质D.HgCl2中既存在离子键也存在共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧元素的质量在数值上等于氧气摩尔质量的是( )
A. 22.4 L氧气 B. 阿伏加德罗常数个氧原子
C. 0.032 kg氧气 D. 1 mol氧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 mol不同气体在不同条件下的体积:
化学式 | 条件 | 1 mol气体体积/L |
H2 | 0 ℃、101 kPa | 22.4 |
O2 | 0 ℃、101 kPa | 22.4 |
CO | 0 ℃、101 kPa | 22.4 |
H2 | 0 ℃、202 kPa | 11.2 |
CO2 | 0 ℃、202 kPa | 11.2 |
N2 | 273 ℃、202 kPa | 22.4 |
NH3 | 273 ℃、202 kPa | 22.4 |
(1)从上表分析得出的结论:
①1 mol任何气体,在标准状况下的体积都约为________。
②1 mol不同的气体,在不同的条件下,体积________(填“一定”“一定不”或“不一定”)相等。
(2)理论依据:相同条件下,1 mol任何气体的体积几乎相等,原因是:
①_____________________________________________;
②_____________________________________________。
(3)应用:在标准状况下,4 g O2的体积为多少升?(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com