
 钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:
钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:分析 (1)根据构造原理,由原子序数即可写出基态原子的电子排布式,进而可写出价电子排布式;
(2)根据等电子体的概念写出符合题目要求的等电子体;
(3)可根据分子的构型来判断碳的杂化方式,四面体形属于sp3杂化,平面形中的碳属于sp2杂化,直线形中的碳属于sp杂化;
(4)根据题目中提供的物理性质来判断晶体类型;
(5)络合物由內界和外界组成,络合物溶于水发生电离生成內界离子(络离子)和外界离子,与BaCl2或AgNO3溶液反应的离子肯定为外界离子,由此可判断络合物的组成;
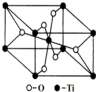
(6)观察晶胞,数数Ti周围距离最近的O的个数即为Ti的配位数.
解答 解:(1)钛为22号元素,基态电子排布式为:[Ar]3d24s2,则基态钛原子的价电子排布式为3d24s2,故答案为:3d24s2;
(2)CO为双原子分子,价电子总数为10,则CO的等电子体为离子的为:CN-(或NO+、C22-),故答案为:CN-(或NO+、C22-);
(3)在CH2Cl2.C6H6.CO2.C2H4中,分子构型分别为四面体形、平面三角形、直线形、平面形,所以碳原子的杂化方式分别为sp3、sp2、sp、sp2杂化,采取sp2杂化的分子有C6H6、C2H4,所以sp杂化的是CO2,故答案为:CO2;
(4)因TiCl4在常温下是无色液体,说明熔点低,在水或潮湿空气中易水解而冒白烟,说明钛离子为弱碱阳离子,由此可判断 TiCl4是由共价键结合的分子,晶体类型属于分子晶体.故答案为:分子;
(5)由[Co(NH3)5Br]SO4可知,硫酸根离子为配合物的外界,在水溶液中以离子形式存在,所以会与钡离子结合成白色沉淀.加入BaCl2溶液时,无明显现象,说明硫酸根离子在内界,若加入AgNO3溶液时,产生淡黄色沉淀,说明溴离子在外界,因此另一配合物的化学式为[Co (NH3)5SO4]Br.
故答案为:产生白色沉淀;[Co (NH3)5SO4]Br;
(6)观察晶胞结构,可知每个钛周围距离最近的氧原子有6个,即钛的配位数为6,故答案为:6.
点评 本题考查了电子排布式的书写、等电子体原理、杂化类型的判断、配合物的组成及性质、晶体类型的判断及晶体结构等知识.这些都是高考的热点,是物质结构和性质的核心,应熟练掌握.本题易错点是没注意题目要求,如价电子排布式写成了基态原子的电子排布式,等电子体要求写离子,容易把分子也写上.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [M1-$\frac{M}{{M}_{2}}$-M]×29 | B. | [M2-$\frac{M}{{M}_{1}}$-M]×29g/mol | ||
| C. | [M2-$\frac{M}{{M}_{1}}$-M]×29 | D. | [M1-$\frac{M}{{M}_{2}}$-M]×29 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | X | Y | Z | W |  |
| ① | Cu | CuSO4 | Cu(OH)2 | CuO | |
| ② | Na | NaOH | Na2CO3 | NaCl | |
| ③ | Al | AlCl3 | Al(OH)3 | Al2O3 | |
| ④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
| A. | ②③ | B. | ①③④ | C. | ①④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeS2既是氧化剂也是还原剂 | |
| B. | CuSO4在反应中被还原 | |
| C. | 14 mol CuSO4氧化了1 mol FeS2 | |
| D. | 被还原的S和被氧化的S的质量之比为3:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将镁块与钢铁输水管相连,可防止钢铁腐蚀 | |
| B. | 石油是混合物,其分馏产品汽油为纯净物 | |
| C. | 金属的腐蚀全部是氧化还原反应 | |
| D. | 石油裂解、煤的气化都包含化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 | 化学名:碳酸钠,俗称苏打 |
| 性状:白色粉末,易溶于水,水溶液呈中性 | |
| 化学式:Na2CO3 | |
| 用途:重要的基本化工原料之一,在纺织、玻璃、制皂、造纸等领域都有广泛应用 |
| A. | 化学名 | B. | 性状 | C. | 化学式 | D. | 用途 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com