
【题目】丙烷的分子结构可简写成键线型结构![]() 。有机物A的键线式结构为
。有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A,下列有关说法错误的是
,有机物B与等物质的量的H2发生加成反应可得到有机物A,下列有关说法错误的是
A.有机物A的一氯代物只有5种
B.用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷
C.有机物A的分子式为C8H16
D.B的结构可能有3种,其中一种的名称为3,4,4-三甲基-2-戊烯
【答案】C
【解析】
由题意知,有机物A的结构简式为(CH3)3CCH(CH3)CH2CH3,有机物B与等物质的量的H2发生加成反应可得到有机物A,说明有机物B中含有一个碳碳双键。
A.有机物A中还有5种等效氢原子,故一氯代物有5种,不符合题意,故A不选;
B.用系统命名法命名有机物A,从左端开始,最长链上有5个碳原子,甲基分别在2、2、3号位,故名称为2,2,3-三甲基戊烷,故B不选;
C.有机物A有8个碳原子,18个氢原子,则分子式为C8H18,符合题意,故C选;
D.碳碳双键能出现的位置有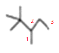 ,共3个,故B的结构可能有3种,当碳碳双键在位置2时,系统命名为3,4,4-三甲基-2-戊烯,故D不选;
,共3个,故B的结构可能有3种,当碳碳双键在位置2时,系统命名为3,4,4-三甲基-2-戊烯,故D不选;
答案选C。


科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g) ΔH=57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g) ΔH=57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
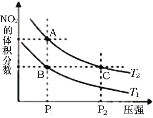
A.由状态B到状态A,可以用加热的方法
B.A、C两点气体的颜色:A深,C浅
C.A、C两点的反应速率:A>C
D.A、C两点气体的平均相对分子质量:A>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子核外电子排布式为__________,N、O、S元素的原子对键合电子吸引力最大的是___________。
(2)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,1mol CN中含有的π键的数目为__________。与CN互为等电子体的离子或分子有__________(写出一种即可)。
(3)[Cu(NH3)4]2+中,提供孤对电子的是___________。Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是___________(填“极性”或“非极性”)分子,由此推知[Cu(NH)4]2+的空间构型是___________。(填“平面正方形”或“正四面体”)
(4)NH3中N原子的杂化方式是___________,硫元素对应的含氧酸酸性是H2SO4强于H2SO3,其原因为___________。
(5)铜的一种氧化物晶体结构如图所示,该氧化物的化学式是___________。若该晶体结构为长方体,其参数如图,阿伏加德罗常数为NA,则该氧化物的密度为___________g/cm3。
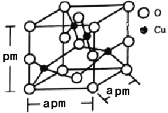
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1).FeCl3是中学实验室常用的试剂,可以用来制备氢氧化铁胶体。
下列制备氢氧化铁胶体的操作方法正确的是____________(填字母);
A.向饱和氯化铁溶液中滴加少量的氢氧化钠稀溶液
B.加热煮沸氯化铁饱和溶液
C.在氨水中滴加氯化铁浓溶液
D.在沸水中滴加饱和氯化铁溶液,煮沸至液体呈红褐色。
(2)写出Ba(OH)2溶液与少量NaHCO3溶液反应的离子方程式:___________________。
(3)写出次氯酸的电子式:________________;写出过氧化钠中存在的所有化学键类型:____________________。
(4)铁粉中含有铝粉,可加______除去杂质,发生的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol·L-1 HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中正确的是
A.25 ℃时,0.1 mol·L-1 HF溶液中pH=1B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中有CaF2沉淀产生D.该体系中,Ksp(CaF2)=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛白粉(TiO2)是重要的白色颜料,LiFePO4是锂离子电池的正极材料。一种利用钛铁矿( 主要成分为FeTiO3 和少量Fe2O3 )进行钛白粉和LiFePO4 的联合生产工艺如下图所示:
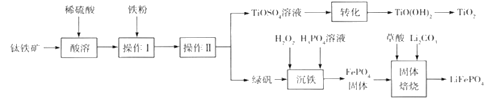
回答下列问题:
(1) LiFePO4中Fe的化合价是_______________________。
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎的目的是__________________________________。
(3)用离子方程式表示操作I加入铁粉的目的:__________________________。操作II为一系列操作,名称是加热浓缩、冷却结晶、过滤,其中用到的陶瓷仪器的名称是___________。
(4)TiO2+易水解,则其水解的离子方程式为______________________;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热的目的是________________________________。
(5)“沉铁”的的是使Fe3+生成FePO4,当溶液中c(PO43-)= 1.0×10-17mol/L时可认为Fe3+ 沉淀完全,则溶液中Fe3+沉淀完全时的c(Fe3+)=_______mol/L[已知:该温度下,Ksp(FePO4)=1.0×10-22]。
(6)由“沉铁”到制备LiFePO4的过程中,所需17% H2O2溶液与草酸( H2C2O4)的质量比是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用AG表示溶液的酸度,其表达式为AG=lg[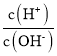 ],298K时,向10mL0.1 molL-1 HX溶液中滴加 0.1molL-1NaOH 溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是 ( )
],298K时,向10mL0.1 molL-1 HX溶液中滴加 0.1molL-1NaOH 溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是 ( )
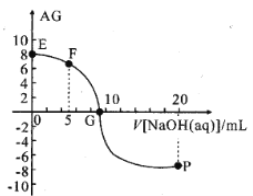
A.溶液pH和AG的关系式为AG=14-2pH
B.对G点溶液,c(Na+) = c(X-)
C.298K时HX的电离常数Ka≈1.0×10-5
D.溶液中水电离的c(OH-) F点<P点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年9月,中国爆发三鹿毒奶粉事件,其原因是奶粉中含有三聚氰胺。三聚氰胺是一种重要的有机化工原料。它的结构简式如图,下列说法中正确的是

A. 该物质可用作食品添加剂
B. 三聚氰胺属于有机高分子化合物
C. 分子中所有原子都在同一平面上
D. 三聚氰胺含氮量很高,能冒充蛋白质通过检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的结构简式为![]() ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。
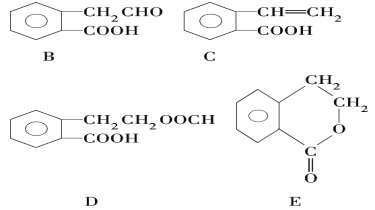
请回答下列问题:
(1)在A~E五种物质中,互为同分异构体的是____________ (填序号)。
(2)C能形成高聚物,该高聚物的结构简式为 _______________________。
(3)指出反应的类型:A→C:_________,E中含有的官能团的名称:_______
(4)写出由A生成B的化学方程式_______________________。
(5)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是__________________(填序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com