
| A、胶体外观不均匀 |
| B、胶体不能通过滤纸 |
| C、胶体粒子不停地无秩序运动 |
| D、胶体不稳定,静止后容易形成沉淀 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,1L0.1mol/L的BaCl2溶液中Cl-数为0.2NA |
| B、1mol羟基中电子数为10NA |
| C、17.6g丙烷中所含的极性共价键为4NA个 |
| D、常温常压下,22.4L乙烯中C-H键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4LH2O含有的分子数为NA |
| B、通常状况下,NA个CO2分子占有的体积为22.4L |
| C、物质的量浓度为1mol/L的MgCl2溶液中,含有Cl-个数为2NA |
| D、常温常压下,1.06gNa2CO3含有的Na+离子数为0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将0.20mol NO和0.1mol CO充入一个容积恒定为1L的密闭容器中发生反应:
将0.20mol NO和0.1mol CO充入一个容积恒定为1L的密闭容器中发生反应:| A、容器内的压强不发生变化说明该反应达到平衡 |
| B、当向容器中再充入0.20 mol NO时,平衡向正反应方向移动,K增大 |
| C、第12 min时改变的反应条件为升高温度 |
| D、向该容器内充入He气,容器内气体压强增大,所以反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
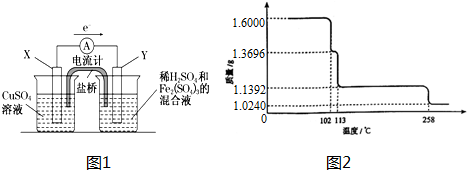
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com