
【题目】(1)某气态氧化物的化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL,则R的摩尔质量为___。
(2)已知CO、SO2的混合气体质量共18.4g,标准状况下休积为8.96L,则可推知该混合气体的平均相对分子质量为___。
(3)标准状况下9.03×1023个CH4所占的体积为___,与___个NH3含有相同数目的氢原子。
(4)与16gN2H4所含有分子数相同的氧气的体积(标准状况)是___L。
(5)质量比为51:28的NH3、CO所含质子数之比为___。
【答案】32g/mol 46 33.6L 1.204×1024或2NA 11.2L 15:7
【解析】
(1)根据![]() 计算;
计算;
(2)根据![]() 计算;
计算;
(3)根据![]() 计算;
计算;
(4)相同物质的量的气体具有相同的分子数;
(5)质量比为51:28的NH3、CO,物质的量比是![]() ;
;
(1)设RO2的摩尔质量是M,![]() ,M=64g/mol,R的摩尔质量为64g/mol-16g/mol×2=32g/mol;
,M=64g/mol,R的摩尔质量为64g/mol-16g/mol×2=32g/mol;
(2)设CO、SO2混合气体的摩尔质量是M,![]() ,M=46g/mol,该混合气体的平均相对分子质量为46;
,M=46g/mol,该混合气体的平均相对分子质量为46;
(3)9.03×1023个CH4的物质的量是![]() 1.5mol,标准状况下9.03×1023个CH4所占的体积为1.5mol×22.4L/mol=33.6L,1.5mol甲烷中氢原子物质的量是6mol,2NA个NH3含有6mol氢原子。
1.5mol,标准状况下9.03×1023个CH4所占的体积为1.5mol×22.4L/mol=33.6L,1.5mol甲烷中氢原子物质的量是6mol,2NA个NH3含有6mol氢原子。
(4)16gN2H4的物质的量是16g÷32g/mol=0.5mol,则含有分子数相同的氧气的物质的量是0.5mol,标准状况的体积是0.5mol×22.4L/mol=11.2L;
(5)质量比为51:28的NH3、CO,物质的量比是![]() ,NH3中质子数是10、CO中质子数是14,则质子数之比为3×10:1×14=15:7。
,NH3中质子数是10、CO中质子数是14,则质子数之比为3×10:1×14=15:7。


科目:高中化学 来源: 题型:
【题目】一定量的![]() 在
在![]() 中燃烧后,所得混合气体用100mL3.00mol/L的NaOH溶液恰好完全吸收,测得溶液中含0.05molNaClO。氢气和氯气物质的量之比是( )
中燃烧后,所得混合气体用100mL3.00mol/L的NaOH溶液恰好完全吸收,测得溶液中含0.05molNaClO。氢气和氯气物质的量之比是( )
A.2:3B.3:1C.1:1D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气与水反应生成的次氯酸具有杀菌作用,常用于自来水的消毒,用此种方法处理的自来水需要经过暴晒后才能用于养金鱼。下列有关说法正确的是
A. 次氯酸中氯元素呈-1价 B. 次氯酸属于电解质
C. 次氯酸的化学性质很稳定 D. Cl2与水的反应中无电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关节炎的成因是在关节滑液中形成尿酸钠晶体——NaUr,其平衡关系为:Ur—(aq)+Na+(aq) ![]() NaUr(s),其中Ur—表示尿酸根离子。医生常嘱咐关节炎病人要注意保暖,特别是手脚等离心脏较远的部位。因为第一次关节炎的发作大都在手指或脚趾的关节处。这说明
NaUr(s),其中Ur—表示尿酸根离子。医生常嘱咐关节炎病人要注意保暖,特别是手脚等离心脏较远的部位。因为第一次关节炎的发作大都在手指或脚趾的关节处。这说明
A. 形成尿酸钠晶体的反应为放热反应 B. 形成尿酸钠晶体的反应为吸热反应
C. 尿酸钠溶解度较大 D. 尿酸钠晶体一定难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. 标准状况下,22.4LCCl4含有的分子数约为6.02×1023个
B. 1L氢气一定比1L氧气质量少
C. 含有6.02×1023个Fe3+的Fe2(SO4)3中SO42﹣的物质的量为3mol
D. 1molAl3+带有的正电荷数为1.806×1024个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的基本化工原料,以乙烷为原料生产乙烯有多种方法。
I.乙烷裂解脱氢法。该方法的反应为:C2H6(g)=C2H4(g)+H2(g) △H=akJ/mol
(1)已知101kPa,298K时,C(s)和H2(g)生成lmoC2H6(g)、1molC2H4(g)的△H分别为-84.7 kJ/mol、+52.3kJ/mol。则a=___________。
II.乙烷氧化脱氢法,在原料气中加入氧气,乙烷氧化脱氢的反应如下:2C2H6(g)+O2(g)![]() 2C2H4(g)+2H2O(g) △H<0,副反应都为放热反应,副产物有CH4(g)、CO(g)、CO2(g)。原料气(70.1%空气、29.9%C2H6)在反应器中停留15s,获得相关数据如下表:
2C2H4(g)+2H2O(g) △H<0,副反应都为放热反应,副产物有CH4(g)、CO(g)、CO2(g)。原料气(70.1%空气、29.9%C2H6)在反应器中停留15s,获得相关数据如下表:
反应温度/℃ | 乙烷转化率/% | 乙烯选择性/% | 产率/% |
750 | 80.5 | 62.9 | 50.6 |
800 | 85.6 | 64.5 | 55.2 |
850 | 92.2 | 63.2 | 58.3 |
900 | 97.6 | 59.0 | 57.6 |
(2)①反应的平衡常数表达式为K=___________,K(750℃)___________K(900℃)(填“>”、“<”、“=”)
②当温度超过800℃时,乙烯的选择性降低,其主要原因可能是________________。
III.催化氧化脱氢法。以Mo-V-Nb-Sb的氧化物为催化剂,在常压、380℃下,反应速率与氧气分压[P(O2)]、乙烷分压[P(C2H6)的关系如下图所示。

(3)已知该反应的速率方程为v=kPm(O2)·Pn(C2H6),则m=___________,n=___________。
IV质子膜燃料电池法。
(4)乙烷氧化制乙烯会产生CO2的大量排放,近年研究人员开发了乙烷氧化制乙烯的质子膜燃料电池(SOFC),该燃料电池的负极反应式为__________,这种电池工作过程中没有CO2排放,原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验试剂保存正确的是( )
A.将氢氟酸保存在玻璃细口瓶中B.将金属钠保存在冷水中
C.保存 NaOH 的试剂瓶使用橡胶塞D.将金属锂保存在煤油中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗是重要的稀缺战略资源,广泛应用于众多国防军工及民用领域,属于我国战略收储金属。某科研课题采用的提取锗技术路线为:低品位锗精矿-(次亚磷酸钠热还原-真空挥发富集)-挥发产物高品位还原锗精矿-碱氧化预处理-盐酸蒸馏提纯-高纯四氯化锗-高纯二氧化锗。

(1)在周期表中金属与非金属的分界处,可以找到半导体材料,如Si、 等,半导体器件的研制正是开始于 ,后来发展到研制与它同族的 。三种元素依次是_______(填标号)。
a.Ge Si Ge
b.Ge Ge Si
c.C Si Ge
(2)请配平次亚磷酸钠热还原反应的化学方程式并在括号内注明反应条件:
___NaH2PO2·H2O+GeO2 ![]() ___Na4P2O7+___H2O+___GeO↑+___H3PO4,_____________
___Na4P2O7+___H2O+___GeO↑+___H3PO4,_____________
(3)高品位还原锗精矿碱氧化预处理过程的产物是锗酸钠,请写出该过程的化学反应方程式:____________________________________________
(4)高纯二氧化锗含量采用碘酸钾滴定法进行分析。称取3.600g高纯二氧化锗样品,采用氢氧化钠在电炉上溶样,次亚磷酸钠加热还原,然后以淀粉为指示剂,用碘酸钾标准溶液(0.6000mol/L)滴定,消耗的碘酸钾体积为19.00mL。[20℃以下,次亚磷酸钠不会被碘酸钾和碘氧化]
①滴定终点的现象是_____________________________。
②此样品中二氧化锗含量是_________。(保留四位有效数字)
(5)用氢气还原GeO2可制得金属锗。其反应如下:
GeO2+ H2= GeO+ H2O ①
GeO+ H2= Ge+ H2O ②
GeO2+ 2H2= Ge+ 2H2O ③
反应式③ΔH=+13750 kJ/mol ,ΔS=+15600J/(K·mol),则还原反应的温度一般控制在_________℃范围内。[已知GeO在700℃会升华,T(K)=t(℃)+273]
(6)锗在硝酸中的溶解速度受硝酸浓度、搅拌速度、温度等因素影响。如图,锗溶解速度有一最大值,硝酸的浓度小于此值时,随浓度增加溶解速度增加,反之降低,这是由于硝酸浓度高时_________加剧所致。
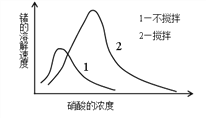
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)2 mol CO(NH2)2中含________mol H,所含氧原子跟________mol H2O所含氧原子个数相等。
(2) 2 mol O3和3 mol O2的质量之比为________,同温同压下的密度之比为________,含氧原子数之比为________。
(3)在9.5 g某二价金属的氯化物中含有0.2 mol Cl-,此氯化物的摩尔质量为__________,该金属元素的相对原子质量为____________。
(4)6.72 L CO(标准状况)与一定量的Fe2O3恰好完全反应(生成Fe与CO2)后,生成Fe的质量为________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com